高考化学热身练试题
可能用到的相对原子质量:H:1 C:12 O:16 Mg:24 Ca:40 Ba:137
第Ⅰ卷(选择题 共64分)
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.近两年我省连发化学品爆炸事故。一座化工厂仓库着火是在搬运桶装亚氯酸钠的过程中引起的;另一起化工厂的爆炸事件是由于仓库渗水,金属镁粉接触水后起火,并随后引燃废料房内的废油引发的。据此,下列说法正确的是
A.亚氯酸钠属于易燃易爆的物质,搬运时应轻装轻卸,切勿猛烈撞击
B.上述两起火灾都可以用水或沙土扑灭
C.金属镁粉活性很强,其还原性比镁各强
D.由于镁粉与石油不能直接反应,故可以放在一起保存
2.以下对生活事实的解释,不正确的是
A.厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解
B.食品添加剂虽然能改善食物的色、香、味,但由于他们对健康有害,均不宜食用
C.用加酶洗衣粉在温水中不能洗涤毛料服装
D.甲醛溶液虽能使细菌的蛋白质变性而死亡,但不宜浸泡海产食品
3.下列描述正确的是
A.2004年我国首创用CO2合成可降塑料聚二氧化碳,使用该塑料仍然产生白色污染
B.超临界流体是介于气态和液态之间的一种状态。故超临界流体CO2是合成的新物质
C.澳大利亚开发出被称为第五形态的固体碳——“纳米泡沫”,其形似海绵,密度极小并有磁性。可以预见,这种新材料的化学性质与金刚石完全不同
D.由于氢键的影响,甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
4.调味剂是日常生活中离不开的食品添加剂,有关其说法正确的是
A.味精主要成分是谷氨酸钠,向其中加入盐酸适当处理可得谷氨酸,谷氨酸具有两性
B.食醋的主要成分是醋酸,将一定量的醋酸溶液稀释,溶液中各离子的浓度都减小
C.食盐是咸味剂,工业上常用电解饱和食盐水制备氯气和钠
D.木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物
5.下列关于工业生产的说法中,错误的是
A.工业上将粗铜进行精炼,应将粗铜连接在电源的正极
B.生产普通玻璃的主要原料有石灰石、石英和纯碱
C.接触法制硫酸过程中,因为常压下SO2的转化率很高,所以不采用高压
D.合成氨的反应是放热反应,因此合成氨工业采用高温
6.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA
B.通常状况下,将0.5mol HI气体和0.5mol氯气混合后气体的分子数为NA
C.18g2H218O所含的中子数为1.8NA
D.53g碳酸钠固体所含离子数为1.5NA
7.下列说法错误的是
①测定中和热时,为了减少热量损失,不要搅拌溶液
②银镜反应实验后,粘有银的试管可用稀氨水洗涤
③向氯化铁溶液里滴入氢氧化钠溶液可以制取氢氧化铁胶体
④SO2气体通入溴水,溴水褪色,说明SO2有漂白性
⑤向含有乙酸杂质的乙酸乙酯中加入氢氧化钠溶液后分液,提纯乙酸乙酯
A.①②④⑤ B.①②③ C.②③④ D.全部
8.下列4组连线中,完全正确的一组是
![]()
![]()
![]()
![]() A.缺铁
会引起贫血
B.喝加钙奶
补充铁元素
A.缺铁
会引起贫血
B.喝加钙奶
补充铁元素
![]()
![]()
![]() 缺钙 会得甲状腺肿大
食用碘盐 补充钙元素
缺钙 会得甲状腺肿大
食用碘盐 补充钙元素
缺碘 会得佝偻病 服补血口服液 补充碘元素
![]()
![]()
![]() C. 碘 抗癌之星 D.少吃油条 加醋后可长时间炖煮
C. 碘 抗癌之星 D.少吃油条 加醋后可长时间炖煮
![]()
![]() 硒 智力之星 治疗胃酸过多 尽量不服用含Al(OH)3的胃舒平
硒 智力之星 治疗胃酸过多 尽量不服用含Al(OH)3的胃舒平
![]() 氟 龋齿克星 使用铝锅
因油条中含有明矾
氟 龋齿克星 使用铝锅
因油条中含有明矾
二.选择题(本题包括8小题,每小题4分,共32分,每题有一个或两个选项符合题意。只有一个选项的,多选不给分;有两个选项的,选对一个给2分,选错一个该题不给分)
9.下列离子方程式中,正确的是
A.向Mg(HCO3)2溶液中加入过量的NaOH溶液
Mg2++2HCO![]() +4OH—
+4OH— Mg(OH)2↓+2CO![]() +2H2O
+2H2O
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO![]() 反应完全
反应完全
2Ba2++4OH—+Al3++2SO![]()
2BaSO↓+AlO![]() +2H2O
+2H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+CO![]() +H2O
+H2O 2HCO![]()
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO![]()
3Fe3++NO↑+2H2O
10.某黄色溶液中可能含有下列离子:K+、NH![]() 、Fe3+、Ba2+、SO
、Fe3+、Ba2+、SO![]() 、HCO
、HCO![]() 、Cl—、S2—,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是
、Cl—、S2—,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是
A.溶液中存在大量Fe3+ B.溶液中可能存在大量Ba2+
C.溶液中不存在大量HCO![]() 和S2— D.溶液可能呈强碱性
和S2— D.溶液可能呈强碱性
11.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH—
+O2+xOH— Fe3O4+S4O![]() +2H2O,
+2H2O,
下列说法中,正确的是
A.每生成1mol
Fe3O4,反应转移的电子总数为4mol B.Fe2+和S2O![]() 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol D.x=2
![]() 12.在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
12.在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8mol·L—1·min—1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol·L—1
13.某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是
A.Al3+、Fe3+、SO42- B.Na+、AlO2-、CO32-
C.Na+、AlO2-、SO42-、CO32- D.Na+、Ba2+、AlO2-
![]() 14.以水为溶剂进行中和滴定的原理是:H3O++OH—
14.以水为溶剂进行中和滴定的原理是:H3O++OH— 2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也能发生自电离:2SO2 SO![]() +SO2+;△H>0。下列叙述中,错误的是 ( )
+SO2+;△H>0。下列叙述中,错误的是 ( )
A.若以液态SO2为溶剂,用SOCl2滴定Na2SO3,该滴定反应可以表示为:
SO![]() +SO2+
+SO2+ 2SO2
B.在一定温度下,液态SO2中c(SO![]() )与c(SO2+)的乘积是一个常数
)与c(SO2+)的乘积是一个常数
C.液态SO2中自电离的存在,说明SO2是离子化合物
D.适当升高温度,液态SO2的导电能力增强
15.下列各离子浓度的大小比较,正确的是 A.NH4+同浓度的下列溶液中:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,则溶液浓度由大到小的顺序是:②>③>①
B.由pH=3的HAc与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:
c(Ac—)>c(Na+)>c(H+)>c(OH—)
C.pH=13 Ba(OH)2与pH=1 HCl溶液等体积混合后,混合液的pH>7
D.将pH=12 Ba(OH)2与pH=14 NaOH溶液等体积混合后,混和液13<pH<14
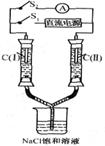 16.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
16.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
A.C(I)的电极名称是负极
B.C(Ⅱ)的电极名称是阳极
C.C(I)的电极反应式是2H++2e一=H2↑
D.C(Ⅱ)的电极反应式是Cl2 +2e一=2Cl一
第Ⅱ卷(非选择题 共86分)
三.(本题包括2小题,共22分)
17.“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。“烂版液”的主要成分是Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。
在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,至pH=8为止。
② 过滤后得到Zn(OH)2沉淀,用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2……
⑴步骤①中控制溶液pH=8的操作是 ;步骤②中如何检验沉淀已经洗涤干净? 。
⑵步骤③中加热的目的是 ;趁热过滤的目的是 。
⑶将步骤④还缺少的操作是 ,所用的主要仪器是 。
18.(12分).碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代 号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
⑴在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
| 时间 | 起始 | 14min后 | 30min后 | 75min后 |
| pH | <2.0 | =2.5 | <3.5 | =3.5 |
试解释排气管中放出气体的pH变化的原因。如果把排气管加长一倍,排气的pH有无变化?为什么? ,
⑵观察反应器内溶液的颜色(取上面清液观察),在沸腾1h内,溶液逐渐呈黄绿色,以后逐渐转变为淡棕黄色,1.5h后呈棕红色。解释导致颜色变化的原因。
⑶上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这是什么物质?为什么此时会有沉淀析出?
⑷铁的化合物和铝的化合物一样也可作净水药剂,此外,溶液中元素Fe还能与CN-形成特定的络合物。某溶液中同时存在Fe(CN)63-和Fe(CN)64-两种离子,H2O2可使它们相互转化,请用离子方程式表示这种转化。
酸性条件:
碱性条件:
四.(本题包括2小题,共18分)
19.已知B、C、D、K都是气体单质,物质A的焰色呈黄色,I为4核10电子中性分子,各有关物质之间的相互反应转化关系如下图所示,反应①--⑤ 都是用于工业生产的反应。

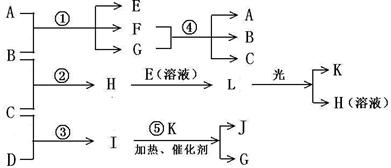
请填写下列空白:
(1)写出下列物质的化学式:B ,J 。
(2)写出下列反应的离子反应方程式:
H+E(溶液)→L ;
F+G →A+B+C 。
(3)若I与E以物质的量比1:2反应,得到F、G和二元素六核化合物M,则M的电子式是
。
(4) 反应④用于工业生产时目前采用如图示装置,该装置的优点有:
① ;
② 。
(5) 如图示装置(溶液体积为100mL), 其阴极的电极方程式是 , 标况下,当电极上产生112mL B气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH= 。
20.(1)若AgC1在水中、0.01 mol·L-1 CaCl2溶液中、0.01 mol·L-1 NaCl溶液中及0.05 mol·L-1AgNO3溶液中的溶解度分别为S1、S2、S3、S4,则S1、S2、S3、S4由大到小的顺序为 。
(2)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关
性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
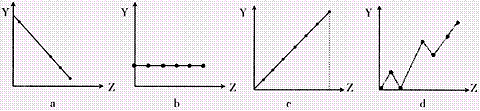 |
①ⅡA族元素的价电子数 ;②第3周期元素的最高化合价 ;
(3)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物的水化物的化学式为 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为 ,B的化学式为 。
③工业上制取单质M的化学方程式为 。
五.(本题包括1小题,共10分)
21.某校化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色黑体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)写出所形成原电池负极的电极反应式: 。
(4)欲利用此反应测定合金中铝的金属,理论上还应该测定哪些数据?请仿照方法①写出另一种不同方法所需数据。
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
[实验二]向实验一的锥形瓶里滴加1 mol·L—1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式: 。
[实验三]取实验二的锥形瓶里的溶液10mL,向其中商加a mLC1mol·L—1NaOH之后,
改成滴加C2mol·L—1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如图所示。
据此,回答下列问题:
|
积的两倍,则C1/C2= ;
(2)所加入NaOH溶液的体积a= mL。
六.(本题包括2小题,共18分)
22.1 mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1 molB和1 molC。B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中C原子数相同,且Mr(B)=Mr(C)+2。
⑴ C的分子式为 ,A的摩尔质量为 ;
⑵ B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式 ;
⑶ C有多种同分异构体,其中属于酯类的同分异构体有 种;
⑷ C分子中苯环上有两个取代基,且苯环上的一氯取代物有两种。写出A的结构简式 。
23.资料:烯烃在一定条件下可被强氧化剂氧化成醛,例如:
RCH=CHR′![]()
![]() RCHO + R′CHO
RCHO + R′CHO
某同学从A出发研究下列所示转化关系:
![]()
(1)A的化学式为___________,E的结构简式__________________________________;
(2)A是一种可以作为药物的有机物,将A在一定条件下氧化可以得到两种有机酸X和Y,X属于芳香族化合物,它在食品保存及染料、药物生产中均有重要作用,则X的结构简式为:_________________________________;
(3)若B的一种同分异构体与到FeCl3溶液呈现紫色,且该同分异物体苯环上的同分异构体只有一种,则符合该条件的同分异物体是____ ___。
(4)在上述转化关系中设计设计步骤A→F的目的是________________ ____;
G→H的化学反应类型是 。
(5)在研究过程中该同学发现从A合成E,有一条比上述简便的方法,请你帮助他完成A→…→E的反应流程图(有机物用结构简式表示,必须注明反应条件)。
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
![]()
![]() 甲苯 ……
E
甲苯 ……
E
七.(本题包括2小题,共18分)
24.在101.3kPa,482K条件下,正癸醛以及分子中碳原子数比它少的醛均为气态,以下变化中,最初与最终情况均维持这种条件。A、B、C3种饱和一元醛分子中碳原子依次增加相同的个数,取等体积的3种醛,分别跟28mL氧气(过量)混合,点燃充分反应发现:A和氧气反应前后的总体积不变;B和氧气反应前后体积增加3mL,C和氧气反应后总体积为反应前的1.2倍。试求:
⑴A的分子式。
⑵原任意一种醛的体积及B、C的分子式。
25.水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO3—的水所形成水垢的化学组成,取干燥的水垢6.32g,加热使其失去结晶水,得到5.78g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到11.82g沉淀。
⑴ 通过计算确定A中是否含有碳酸镁;
⑵ 5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量。(空格不一定填滿)
| 各成分的化学式 | ||||
| 各成分物质的量 |