高考化学复习二模模拟考试(二)
命题:张 逵 审核:顾海东
本试卷分第一卷(选择题)和第二卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第一卷(选择题 共64分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32
Cl-35.5 Cu-64 Ba-137
一.单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1、下列说法正确的是:
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A.①②③ B.①④⑤ C.②③④ D.③④⑤
2、下列叙述正确的是:( )
A.同周期元素的原子半径以ⅦA族的为最大
B.同主族两种元素原子的核外电子数的差值可能为26
C.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂
3、在一无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强,某学生还要鉴定此溶液中是否大量存在 ① Cu2+ ② Fe3+ ③Cl- ④ NO3- ⑤ S2- ⑥ CO32- ⑦ NH4+ ⑧ Mg2+ ⑨ Al3+ ⑩ AlO2-。其实这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
A、①②③⑤⑥⑩ B、①②⑤⑥⑧⑨ C、③④⑦⑧⑨ D、③⑤⑥⑦⑩
4、已烯雌酚是一种激素类药物,结构如下,下列有关叙述中不正确的是
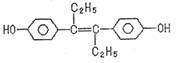
A.可以用有机溶剂萃取
B.可与NaOH和NaHCO3发生反应
C.1mol该有机物可以与5molBr2发生反应
D.该有机物分子中,可能有18个碳原子共平面
5、下列有关说法正确的是
A.溴乙烷水解后的碱性溶液不能用硝酸酸化,因为硝酸会把Br—氧化,再加入AgNO3溶液则不会产生浅黄色沉淀
B.为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色
D.检验溶液中是否含有SO42-时,在无其它阳离子干扰时,所加的BaCl2溶液用盐酸酸化
6、将硝酸铵晶体溶于水中,下列变化曲线(其中a代表扩散过程中温度变化情况,b代表水合过程中温度变化情况)中符合实际的是
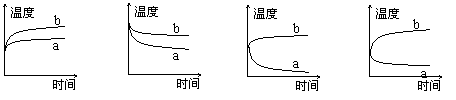
(A) (B) (C) (D)
7、下列各组离子能在指定环境中大量共存的是
A.在c(HCO![]() )=0.1mol/L的溶液中:NH
)=0.1mol/L的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.在使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
C.pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO![]()
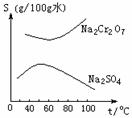 8、根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得
8、根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得
到Na2Cr2O7,需要进行三个操作。这三个操作不包括
A. 升温结晶
B. 趁热过滤
C. 降温结晶
D. 蒸发结晶
二.不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、金属离子和硫离子在水溶液中的反应比较复杂,其产物与离子的水解、金属硫化物的溶解度、离子氧化性或还原性等因素有关。资料表明,CuS的溶解度很小,在稀酸溶液中也不溶解;Fe2S3的溶解度更小,但却溶于稀酸。下列对有关说法正确的是( )。
A.Cu2+和S2-在水溶液中反应的产物是CuS
B.NH4+和S2-在水溶液中发生相互促进水解,所以不存在(NH4)2S的水溶液
C.Fe3+和S2-在酸性溶液中反应的产物是Fe2+、S和H2S
D.在酸性溶液中,S2-还原Fe3+的能力比还原Cu2+强
10、关于下列各装置图的叙述中,错误的是

A.装置①中,c为阳极,d为阴极
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
11、将16 g FeS与FeO的混合物,投入到含有1 mol的硝酸溶液中充分反应,只产生![]() mol NO气体,得到澄清的混合溶液,下列计算结果正确的是
mol NO气体,得到澄清的混合溶液,下列计算结果正确的是
A.混合物中含有0.1 mol FeS B.混合物中含有8 g FeO
C.被还原的HNO3 为![]() mol
D.参加反应的HNO3 为1 mol
mol
D.参加反应的HNO3 为1 mol
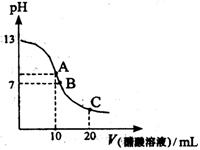 12、25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是:( )
12、25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是:( )
A.在A点:c(Na+)> c(OH—)> c(CH3COO—)> c(H+)
B.在A点:c(Na+)+ c(H+)==c(OH—)+c(CH3COO—)
C.在B点:c(CH3COO—)> c(Na+)> c(H+)= c(OH—)
D.在C点:c(CH3COO—)> c(Na+)> c(H+)> c(OH—)
13、下列离子方程式正确的是
A.Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.3 mol的Cl2 通入含2 mol FeI2的溶液中: 2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2
C.甲醛溶液中加入足量的银氨溶液并加热
HCHO+ 2[Ag (NH3)2]
++2OH-![]() HCOO—+NH4++2Ag↓+3NH3+H2O
HCOO—+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量的CO2 :2C6H5O-+CO2+H2O→2C6H5OH+CO32-
14、用惰性电极电解硫酸铜和盐酸的混合溶液,则阴、阳两极产生的气体成分及体积比不可能是
A、阳极为纯净气体,阴、阳两极产生的气体的体积比≤1:1
B、阳极为纯净气体,阴、阳两极产生的气体的体积比≥1:1
C、阳极为混合气体,阴、阳两极产生的气体的体积比≤1:1
D、阳极为混合气体,阴、阳两极产生的气体的体积比≥1:1
15、某混合物中含有KCl、NaCl、Na2CO3,欲分析Na2CO3的质量分数(以a%表示),以下叙述中正确的是
| 已测出的元素的质量分数 | 结论 | |
| A | Cl:b% | a% <(1- ) |
| B | Cl:b%;Na:c% | 可求出的a%数值 |
| C | Cl:b%;K:d% | 只可确定a%的取值范围 |
| D | Na:c%;K:d% | 可求出的a%数值 |
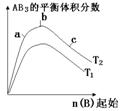 16、某化学科研小组研究其他条件不变时,改变某一条件对A2(g)+3B2(g)
16、某化学科研小组研究其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图的变化规律(图中T表示温度,n表示物质的量),根据如图所示可以得出的结论正确的是:
2AB3(g)化学平衡状态的影响,得到如下图的变化规律(图中T表示温度,n表示物质的量),根据如图所示可以得出的结论正确的是:
A、正反应一定是放热反应
B、达到平衡时,A2的转化率大小为b>a>c
C、正反应一定是吸热反应,且T2>T1
D、b点时,平衡体系中A、B原子个数比接近1:3
第二卷(非选择题 共86分)
三.(本题包括2小题,共20分)
17、江苏宝胜集团是一家以生产电缆类产品为主的国家大型企业。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。
甲同学根据已学知识,提出了一套回收方案:
 |
![]() 乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4
+ 2H2O),于是他提出了另一套方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4
+ 2H2O),于是他提出了另一套方案:
 |
(1)甲方案的①②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ;② ;③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)的方案更合理。理由是: 。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”。请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。请写出使“绿矾”结晶的两种可能方法: 、 (“绿矾”溶解度随温度升高而增大)。如果直接排放掉滤液,不仅造成了浪费,还会 。
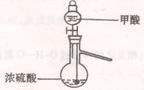
18、甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸========H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
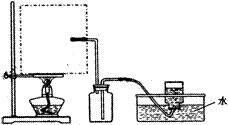 ①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
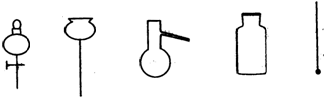
Ⅰ制备CO Ⅱ Ⅲ收集CO 分液漏斗 长颈漏斗 蒸馏烧瓶 集气瓶 温度计
②装置Ⅱ的作用是 。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3== Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O==2 Cu(HCOO)2·4H2O+ CO2↑
 实验步骤如下:
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
③步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是 。
④步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到 (填写实验现象),说明温度过高。
Ⅱ、甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是 。
⑥用乙醇洗涤晶体的目的是 。
四.(本题包括2小题,共19分)
19、(一)将NH4Cl溶液用盐酸调制成pH=4的溶液,然后进行电解,发现制成了一种常见的二元化合物A,用空气把气体产物带出电解槽即得到较为纯净的A,其结构与NH3相似。
(1).试确定A
(2).若A可水解,试写出其离子方程式 若所得产物可进一步反应则所得主要产物为
(3).将A与NaClO2按物质的量之比1∶6混合,可得到一种绿色环保的消毒剂B以及能使湿润的红色石蕊试纸变蓝的气体C且所得溶液呈碱性。B的消毒效果是同物质的量的Cl2的2.5倍。试写出其反应的离子方程式
(二)物质微观结构一直是科学家不断探索的重要问题,请填写下列空挡:
原子簇化学是当前化学中最饶有兴趣而又极其活跃的领域之一。当前比较全面的定义是由徐光宪、江元生等人提出的:凡以3个或3个以上原子直接键合构成的多面体或笼为核心,连接外围原子或基团而形成的结构单元称原子簇。分子式为CnHn的多面体碳烷是典型的主族簇合物,下面是已经报道的碳烷多面体:
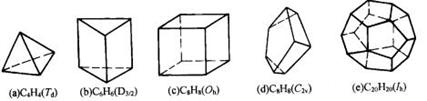
(1)e分子与C60属_______。(填写编号)
A.同系物 B.同分异构体 C.同素异形体 D.无关系
(2)其中b分子的二硝基代物有______种,d分子的一氯一溴代物有______种。
(3)请分析并归纳:分子式为CnHn的多面体碳烷中总键数为___________(用n表示);若多面体边数为m,则总键数用n和m表示为多少____________(用n和m表示)。
(4)最近科学家发现了碳的第五种同素异形体——很轻,就像泡沫一样称为纳米泡沫。在纳米泡沫中,碳是以七边形的方式结合,因此造成有一个未成对的电子,所以可以预测纳米泡沫最重要的物理性质是_________________________;Michigan State University的David Tománek认为可以用纳米泡沫来把肿瘤包起来,以红外线加热摧毁肿瘤,达到保护外围组织的安全,所以可以推测它具有_________________________这一物理性质。
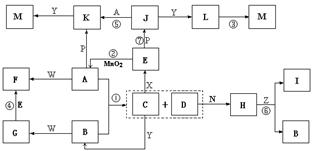 20、下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
20、下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
请按要求回答:
(1)写出C的电子式 ,I的化学式 ;
(2)反应③的化学方程式为 ;
(3)反应④的离子方程式为 ;
(4)由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
五.(本题包括1小题,共11分)
21、Fe是地壳中含量很丰富的元素,也是生物体所必须的元素。
(1)我国南方某些地区的井水取出久置之后,井水由澄清变成少量红棕色絮状沉淀积于缸底,水面浮着一层“锈皮”。这层“锈皮”的主要成分是(写化学式) 。
(2)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
(填字母代号);
A.4Fe(OH)2 + 2H2O + O2 == 4Fe(OH)3 B.2Fe + 2H2O + O2 == 2Fe(OH)2
C.2H2O + O2 + 4e- == 4OH- D.Fe – 3e- == Fe3+
(3)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3+ + SO32- + H2O == 2Fe2+ + SO42- + 2H+;二是发生双水解反应:2Fe3+ +3SO32- +6H2O == 2Fe(OH)3(胶体) + 3H2SO3。为了证明是哪一种反应,同学们设计并实施了下列实验,请填写下列空白:
①实验Ⅰ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变为血红色,反应的离子方程式为 。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式 。
②实验Ⅱ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ,产生的现象完全相同。由上述实验得出的结论是 。
③若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。
④从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
Ⅰ. ;Ⅱ. ;
(4)自然界中铁矿石主要有赤铁矿和磁铁矿,应用高炉能冶炼制得金属铁。Fe3O4在高炉中有下 列反应:Fe3O4 + CO == 3FeO + CO2 反应形成的固体混合物(FeO、Fe3O4)中,元素氧和铁的质量比用m(O)∶m(Fe)表示。设Fe3O4被CO还原的质量分数为x,则x与混合物中m(O)∶m(Fe)的关系式(用含m(O)、m(Fe)的代数式表示):x= 。
六.(本题包括2小题,共18分)
22、1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:
![]() RX+Mg
RX+Mg![]() RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有一定对称性。合成线路如下:
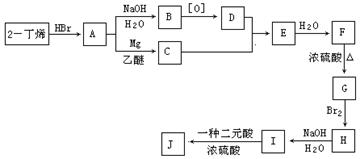
请按要求填空:
(1)3,4-二甲基-3-己醇是: (填代号),E的结构简式是 ;
(2)C→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
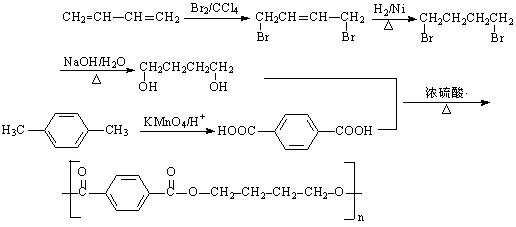
23、塑料是日常生活中常用的合成高分子材料,常用塑料F、G均可由某烃经下列反应得到:
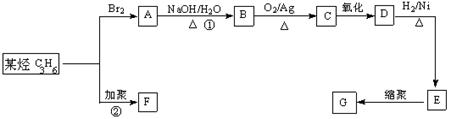
(1)写出高分子化合物G的结构简式:_____________________;
(2)写出反应①的化学方程式:_________________________________________;
(3)写出反应②化学方程式:_____________________________________________;
(4)PBT(![]() )是一种最重要的工程塑料之一。
)是一种最重要的工程塑料之一。
已知:①、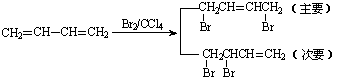
②、
请设计方案以CH2=CHCH=CH2、![]() 为原料合成PBT;请用反应流程图表示,并注明反应条件。示例:由乙醇合成聚乙烯的反应流程图可表示为
为原料合成PBT;请用反应流程图表示,并注明反应条件。示例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() CH2-CH2
CH2-CH2![]()
合成PBT的反应流程图为__________________________________________________
七.(本题包括2小题,共18分)
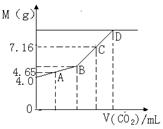
24、往200mLNaOH溶液中通入CO2,充分反应后,在减压和低温下,小心将溶液蒸干,得白色固体M。通入CO2的体积V(CO2)(mL)(标准状况下)与M的质量(g)的关系如右图。试通过分析和计算回答下列问题(要求写出简要计算过程):
(1)B点时,白色固体M的化学式是 ,通入CO2的体积为 mL
(2)D点时,通入CO2的体积为 mL
(3)C点时,通入CO2的体积为 mL
(4)取组成为A点的白色固体十分之一,配成溶液,向其中逐滴加入0.1mol﹒L-1HCl溶液,请在右图画出产生CO2气体体积(标准状况下)与所加盐酸的体积关系。
25、在110℃,101kPa下,一定量的某物质A跟一定量的氧气充分反应后,将反应后得到的气体全部缓慢通过足量的Na2O2固体。请回答下列问题:
(1)若A是2gH2,跟足量氧气反应后,按上述方式通过Na2O2,则Na2O2固体质量增加__________g,
(2)若A是6g碳,与16g氧气反应后,按上述方式通过Na2O2,则Na2O2固体质量增加__________g,
(3)若A在通常状况下是气态烃,0.25molA跟足量氧气反应后,按上述方式通过Na2O2,Na2O2固体增加的质量比烃的质量多16g,则A的分子式可能是(写出三种即可)
_______________________、_______________________、____________________________,
(4)若A的分子式是CxHyOz(x、y、z均为正整数),一定量的A跟足量氧气反应后,按上述方式通过Na2O2,Na2O2固体增加的质量跟A的质量相等,则A中z、y、z满足的关系式是(请用两个关系式表示,其中一个只含x和y,另一个只含x和z):
____________________________________。
参考答案
1、C 2、B 3、A 4、B 5、D 6、C 7、B 8、D
9、AC 10、C 11、AC 12、BD 13、B 14、B 15、 BD 16、D
17、(每空1分,共10分)
(1)① 2Cu + O2 加热 2CuO ② CuO + H2SO4 === CuSO4 + H2O ③ Fe + CuSO4 === FeSO4 + Cu 。
(2)乙 。甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾。(关键词:“污染空气”)
(3)“确保CuSO4 用完”或“将Cu完全置换出来”,其他类似说法均可。
将所得铜粉酸洗后再洗涤、干燥;或过滤前在加适量的酸以除去剩余的铁粉。
(4)蒸发 、降温 。 水污染或环境污染。
18、(10分)仪器选择正确并标时液体1分,温度计水银球的位置1分
 ②防止水槽中的水因倒吸流入蒸馏烧瓶中(1分)
②防止水槽中的水因倒吸流入蒸馏烧瓶中(1分)
③研细并混合均匀(各1分,共2分)
④出现黑色固体(1分)
⑤防止甲酸铜晶体析出(2分)
⑥洗去晶体表面的水和其它杂质(2分)
19、(每空1分,共11分)(一)1.A:NCl3;
2. NCl3+3H2O=NH3+3HClO N2和HCl
3.NCl3+3H2O+6ClO2-→6ClO2+3Cl-+3OH-+NH3↑
(二)(1)D (2)3 8
(3)[(3n/2)+n]=5n/2; (4n-m) [或m+n]
(4)能导电(或带有磁性); 导热性极差;
![]() 20、(8分)(1)
20、(8分)(1)
Mg(OH)2 (每空2分)
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
(3)Ag(NH3)2++2H++Cl-=2NH4++AgCl↓(2分)
(4)C为固体,X为浓溶液 无氧(每空1分)
21、(每空1分共11分)(1)Fe2O3 (1分) (2)D(1分)
(3)①氢氧化铁胶体,(1分)先产生红褐色沉淀,后沉淀逐渐溶解,溶液变成黄色且有气泡产生(1分)Fe3+ + 3SCN-== Fe(SCN)3 (1分) Ba2+ + SO42-== BaSO4↓(1分)
②Fe3+与SO32-同时发生氧化还原反应和双水解反应(1分)
③2Fe3+ + 3CO32- + 3H2O == 2Fe(OH)3↓+ 3CO2↑(1分)
④SO32-有较强的还原性,CO32-没有还原性(1分)
![]() SO32-水解能力较CO32-小(1分)
SO32-水解能力较CO32-小(1分)
(4) (1分)
![]() 22、(共8分)
22、(共8分)
(1)F (1分) (1分)
(2)加成反应(1分) 消去反应(1分)
(3)CH3CH2CHBrCH3+NaOH![]() CH3CH2CH(OH)CH3+NaBr(2分)
CH3CH2CH(OH)CH3+NaBr(2分)
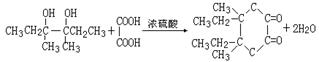 (2分)
(2分)
23、(1)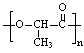 (1分)
(1分)
(2)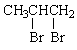 +2NaOH
+2NaOH![]()
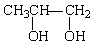 +2NaBr 2分
+2NaBr 2分
(3)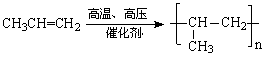 2分
2分
(4)(5分)
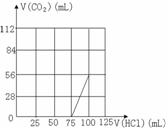
24、(1)Na2CO3 1120 (共2分)
(2)2240 (2分) (3)1792 (2分)
(4)(2分)
25、 (1)2 (2分)
(2) 14 (2分)
(3)C4H10,C4H8,C4 H6等 (3分)
(4)x=z(1分),y≤2x+2(2分) (3分)