![]()
|
|
学科: 化学 |
| 教学内容:卤族元素 |
【基础知识精讲】
一、卤素的原子结构
卤素包括:F、Cl、Br、I、At(其中At为放射性元素,中学不作研究),它们的原子结构示意图分别为:
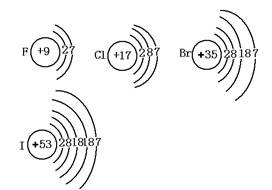
相同点:最外层都有7个电子,易得到一个电子形成8个电子的稳定结构,单质均为双原子分子.
递变性:
1.电子层数依次增多
2.原子半径依次增大
3.原子半径小于相应的离子半径
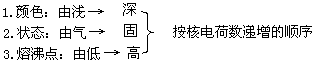
二、卤素单质的物理性质
三、卤素的化学性质
单质呈现强氧化性,但随核电荷数的增加,原子核对外层电子的吸引能力逐渐减弱,它们得电子的能力也逐渐减弱,单质的氧化性F2>Cl2>Br2>I2.
1.与H2的反应:X2+H2 = 2HX
①.单质与氢的化合能力逐渐减弱,条件逐渐升高.
②.气态氢化物的稳定性:HF>HCl>HBr>HI
水溶液酸性:HF<HCl<HBr<HI
2.与H2O的反应:X2+H2O = HX+HXO
①单质与H2O反应的程度越来越小.
②特例:2F2+2H2O = 4HF+O2
原因:氧化性F2>O2,卤素中只有F无正价,其它元素除有-1,0价外,还均有+1、+3、+5、+7价
3.与金属反应:生成金属卤化物(设为RXn)
2R+nX2 = 2RXn
当R为Fe时,F2、Cl2、Br2均生成FeX3,而I2通常生成FeI2.
4.卤素单质的置换反应
2KBr+Cl2=2KCl+Br2
2KI+Cl2=2KCl+I2
2KI+Br2=2KBr+I2
非金属活泼性(或氧化性):F2>Cl2>Br2>I2
还原性:F-<Cl-<Br-<I-
5.卤化银和卤素离子的检验
| AgF | AgCl | AgBr | Agl | |
| 色态 | 白色固体 | 白色固体 | 淡黄色固体 | 黄色固体 |
| 溶解性(水) | 易溶 | 难溶 | 难溶 | 难溶 |
| 稳定性 | 稳定 | 不稳定 | 不稳定 | 不稳定 |
| 主要用途 | / | / | 感光材料 | 人工降雨 |
四、可逆反应
1.概念:正反应,向生成物方向进行的反应.
逆反应:向反应物方向进行的反应.
可逆反应:在同一要件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应.
2.特点:同一条件,同时进行.
3.表示方法;在化学方程式里,用两个方向相反的箭头代替等号来表示可逆反应.如H2+I2![]() 2HI
2HI
【重点难点解析】
1.卤族元素性质的特殊性
(1)氟元素:①CaF2不溶于水、AgF溶于水
②HF为弱酸,其它氢卤酸为强酸
③F-不能被氧化剂氧化,其它卤离子均能被氧化
④HF能腐蚀玻璃,其它氢卤酸不能腐蚀玻璃
⑤氟无正价,无含氧酸,其它卤素都有正价,有含氧酸.
⑥F2与水反应生成HF和O2,其它卤素有单质的水溶液
(2)溴元素:Br2为绿红棕色液体,很易挥发,冰封保存
(3)碘元素:
①I2遇淀粉溶液呈蓝色(用于鉴定I2的存在)
②I2受热升华
③I2+Fe=FeI2(I2氧化性弱,盛I2的试剂瓶不能用铁盖)
2、卤化氢的制备
由于HBr、HI都有较强的还原性,都能被浓硫酸和硝酸氧化,因此,HF、HCl可用浓硫酸制取,而HBr、HI用浓磷酸或用1∶1的硫酸制取.
CaF2+H2SO4(浓) ![]() CaSO4+2HF↑ (在铅皿中)
CaSO4+2HF↑ (在铅皿中)
NaBr+H3PO4(浓) ![]() NaH2PO4+HBr↑
NaH2PO4+HBr↑
KI+H3PO4(浓) ![]() KH2PO4+HI↑
KH2PO4+HI↑
3、萃取和分液的实验操作和原理
(1)原理:利用溶质在两种互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从另一种溶剂中提取出来
(2)操作:①混合振荡 ②静置 ③分液
(3)注意 ①萃取剂应具备的条件 a.萃取剂和原溶剂互不相溶
b.萃取剂和原溶质不发生反应
c.溶质在萃取剂中的溶解度要远大于在原溶剂中的溶解度.
②萃取常在分液漏斗中进行,分液是萃取操作中的一个步骤.
③分液时,打开分液漏斗活塞,将下层液体从下口流出,与下层液体刚好放完时立即关闭活塞,上层液体从分液漏斗上口倒出.
【难题巧解点拨】
例1 把含有某一种氯化物杂质的氯化镁粉末95mg溶于水后,与足量的硝酸银溶液反应,生成氯化银沉淀300mg,则该氯化镁中的杂质可能是( )
A.NaCl B.AlCl3 C.KCl D.CaCl2
分析 极值分析法 假设95mg粉末全部是氯化镁,将它溶于水后与足量AgNO3溶液反应得143.5×2=287mgAgCl沉淀,而现得300mg沉淀,说明氯化镁中的杂质含氯量比MgCl2中含氯量高,可能是2NaCl、2/3AlCl3、2KCl、CaCl2中化学式式量小于MgCl2式量的物质,故选(B).
例2 现有AgCl和AgBr的混合物1.85g,若将此混合物中的AgBr全部转化为AgCl,质量会减少0.2g.求混合物中AgBr和AgCl各是多少g?
解:差量法
AgBr~AgCl 质量差
188 143.5 143.5-188=44.5
m(AgBr) 0.2g
m(AgBr)=![]() =0.85(g),故m(AgCl)=1.85-0.85=1(g).答:(略)
=0.85(g),故m(AgCl)=1.85-0.85=1(g).答:(略)
例3 砹(At)是原子序数最大的卤族元素,推测砹及其化合物最不可能有的性质是( )
A.At很稳定 B.砹易溶于有机溶剂
C.AgAt不溶于水 D.砹是有色固体
分析 用族元素性质上的相似和递变规律来进行预测①溶解性相似性;②HX的稳定性递变律;③AgX溶解性递变律;④单质颜色的递变律,很容易推出答案为A.
【课本难题解答】
P29 五(1)c(HNO3)=![]() =0.014mol/L
(2)V=
=0.014mol/L
(2)V=![]() =2.14L
=2.14L
【典型热点考题】
例1 下列试剂保存方法不正确的是( )
A.AgNO3溶液保存在棕色细口瓶中
B.氢氟酸保存在特制塑料瓶中
C.澄清石灰水保存在带胶塞的无色细口瓶中
D.AgBr保存在无色试剂瓶中
解析 A、B、C保存试剂的方法都是正确的,故它们为无效选项,而D项AgBr应保存在棕色试剂瓶中.液体试剂保存在细口瓶中,固体试剂保存在广口瓶中.
答案 D
例2 用溴水作试剂可以将下列各组中的溶液鉴别出来的是( )
A.水、汽油、酒精 B.AgNO3、NaOH、KI
C.NaCl、NaBr、NaI D.汽油、酒精、NaOH
解析 该题涉及某些物质的物理性质和化学性质.汽油能夺取溴水中的溴而汽油与水不互溶,得到分层现象,且上层橙色,下层几乎无色,酒精、水均与溴水互溶,得到的溶液显橙黄色,NaOH与Br2反应使溶液为无色.在A、D两个选项中,A不能区别,D组能用溴水区别,B组有三个反应出现三个不同的现象,即浅黄色沉淀;溴水褪色;溶液显褐色.故B组能区别,C组前两种无反应,现象相同,故不能区别,答案为B、D.
答案 BD
例3 溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,跟水反应的化学方程式为:IBr+H2O=HBr+HIO,则下列关于IBr的叙述中,不正确的是( )
A.固态溴化碘是分子晶体 B.和NaOH溶液反应生成NaBr和NaIO
C.IBr分子中存在极性共价键 D.与水反应,IBr既是氧化剂又是还原剂
解析 解答该题时必须抓住题给信息:IBr的化学性质与卤素单质相似及IBr与水反应的方程式.要认识到IBr是卤素共价化合物,不是单质,不能运用卤素单质性质的思维定势去解题.
IBr和卤素单质一样是由共价键形成的分子,其晶体应是分子晶体.由题给反应方程式可知,IBr与NaOH溶液作用的产物应是NaBr和NaIO.因为元素的非金属性Br>I,所以IBr分子中原子间的共用电子对偏向Br原子,该共价键有极性,分子中碘原子显+1价,溴原子显-1价,跟水反应后产物中溴、碘化合价一致,所以IBr与水的反应不属于氧化还原反应.
答案 D.
例4 如右图装置中,烧瓶中充满了干燥气体a,将滴管中的液体b挤入烧瓶中,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:( )

| a(干燥气体) | b(液体) | |
| (A) | NO2 | 水 |
| (B) | CO2 | 4mol·L-1NaOH溶液 |
| (C) | Cl2 | 饱和NaCl溶液 |
| (D) | NH3 | 1mol·L-1盐酸 |
解析 (A)不是正确答案,NO2虽易溶于水,但它同时还生成气体NO:
3NO2+HO2 = 2HNO3+NO
即使会使烧杯内的水有部分进入烧瓶中也不能几乎充满烧瓶.
选项(B)是正确答案,因为NaOH溶液可以大量地吸收CO2.
2NaOH+CO2 = Na2CO3+H2O
当CO2过量时,甚至生成NaHCO3
Na2CO3+CO2+H2O = 2NaHCO3
上述两种溶液都易溶于水,因而造成烧瓶内压强大大降低,也可以形成喷泉.选项(C)不是正确答案,联想实验室中收集Cl2用排饱和食盐水法可知:饱和NaCl溶液不能吸收Cl2.
选项(D)是正确答案,盐酸很易与NH3发生反应生成溶于水的NH4Cl
NH3+HCl = NH4Cl
因而可使烧瓶内压强急剧降低,形成喷泉.
答案 B、D
例5 市售的碘常含有杂质氯、溴、水.如何除去这些杂质?(要求:①写出加入试剂的名称;②除杂质方法中如属化学变化的要用化学方程式表示;③除杂质方法如属物理变化的要简要叙述除杂质的过程.)
解析 物质的提纯,是利用被提纯物质与杂质的性质不同选择适当的实验手段将杂质除去.除杂质时要求在操作中不能再引入新杂质.在除去杂质时要正确选择试剂,所选的试剂一般只能与杂质反应,而不与被提纯物质反应.
本题属提纯问题,可采用转化分离提纯法.先加入KI,Cl2和Br2转化为KCl、KBr.用吸水剂CaO吸水,再利用碘易升华的性质,通过升华法将碘与固体分离.
①碘化钾、生石灰;
②Cl2+2KI = 2KCl+I2,
Br2+2KI = 2KBr+I2
CaO+H2O = Ca(OH)2
③混合物放在烧杯里,烧杯用一个盛有冷水的烧瓶盖上.加热时碘发生升华,蒸气遇冷凝结在烧瓶底部外侧而与杂质分离.

【同步达纲练习】
一、选择题:
1.卤素单质的性质与F2>Cl2>Br2>I2的变化规律不符合的是( )
A.与H2反应的难易程度 B.非金属的活泼性
C.单质的氧化性 D.熔、沸点
2.下列变化规律错误的是( )
A.微粒半径:F-<Cl-<Br-<I- B.稳定性:HI>HBr>HCl>HF
C.还原性:F-<Cl-<Br-<I- D.氧化性:F2<Cl2<Br2<I2
3.欲将食盐固体与碘的混合物分开,最好的方法是( )
A.溶解、过滤 B.溶解、过滤、蒸发
C.溶解、加AgNO3,过滤 D.加热升华
4.下列关于卤族元素,由上到下性质递变的叙述,正确的是( )
①单质的氧化性 ②单质的颜色加深 ③气态氢化物的稳定性减弱
④单质的沸点升高 ⑤离子半径增大
A.①②③ B.②③④ C.②③⑤ D.①③⑤
5.下列反应属氧化还原反应但水既不是氧化剂,又不是还原剂的是( )
A.2Na2O2+2H2O = 4NaOH+O2 B.2Na+2H2O = 2NaOH+H2
C.2F2+2H2O = 4HF+O2 D.Cl2+H2O = HCl+HClO
6.在NaBr和NaI的混合物溶液中通入过量的Cl2把溶液蒸干后并将剩余物灼烧,最后剩余物质是( )
A.NaCl Br2 I2 B.NaCl I2 C.NaCl Br2 D.NaCl
7.甲、乙、丙三种溶液各含一种X-(X-为Cl-、Br-、I-)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化,则甲乙丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
8.实验室制取下列气体时,所用的发生装置相同的是( )
A.H2和CO2 B.H2和O2 C.Cl2和HCl D.O2和HCl
9.有一种碘和氧的化合物可以称为碘酸碘,其中碘元素呈+3,+5两种价态,则这种化合物的化学式是( )
A.I2O4 B.I3O5 C.I4O7 D.I4O9
10.向含有mgKBr的溶液中滴入一定量Cl2将溶液加热蒸干得到固体ng则被还原的Cl2的物质的量一定为( )
A. ![]() ×2mol B.
×2mol B.
![]() ×
×![]() mol
C.
mol
C. ![]() ×2mol D.
×2mol D.
![]() mol
mol
二、填空题
11.卤素在自然界里均以 态存在.卤素中 元素是最活泼的非金属元素.它的单质与水反应的化学方程式为 卤化氢的稳定性顺序是 还原性由强到弱的顺序是 .
12.A、B、C、D、E五个集气瓶中分别充满Cl2、O2、H2、HCl、HBr五种气体中的一种.其中A瓶中的气体是黄绿色.D和A气体混合见光会爆炸;B和A中的气体混合在瓶壁上出现橙红色液滴;将E瓶打开在潮湿的空气中会出现白雾.判断各为什么气体:A B
C D E
三、计算题
13.在一定量的KBr溶液中进入一定量的Cl2,使之反应完全后再将溶液蒸干得到干燥残渣40g.经分析得知含化合态溴为25%求通入Cl2的体积(标况)为多少升?
【素质优化训练】
一、选择题
1.医生建议患甲状腺肿大的病人多食海带,这是由于海带中含有丰富的( )
A.碘元素 B.铁元素 C.钾元素 D.锌元素
2.下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是( )
①2HClO4+Br2(气) = 2HBrO4+Cl2 ②2NaBr+Cl2 = 2NaCl+Br2
③2KI+Cl2 = 2KCl+I2 ④2KI+Br2 = 2KBr+I2
A.①②③ B.①②④ C.②③④ D.①②③④
3.18世纪70年代.瑞典化学家舍勒在研究一种白色的盐时发现在黑暗中此盐并无气味,而在光照时开始变黑并有刺激性气味.此盐是( )
A.AgF B.AgCl C.AgBr D.AgI
4.当装有氯气的毒气弹顺风爆炸时,以下应急措施可行的是( )
A.躲到低洼的地方 B.应到较高的地方
C.用肥皂水浸湿软布蒙面 D.多饮一些豆浆和牛奶
5.鉴别NaCl、NaBr、KI三种无色溶液,下列方法可使用的是( )
A.焰色反应 B.滴加AgNO3试液
C.滴加氯水 D.滴加溴水
6.ICl(氯化碘)的化学性质跟氯气相似、预计它跟水反应的最初生成物是( )
A.HI和HclO B.HCl和HIO
C.HClO3和HIO D.HClO和HIO
7.已知①2FeCl3+2KI=2FeCl2+I2+2KCl
②H2S+I2=2HI+S↓
③2FeCl2+Cl2=2FeCl3↓
下列微粒中氧化能力由大到小的顺序是( )
A.Cl2>Fe3+>I2>S B.S>I2>Fe3+>Cl2
C.Fe3+>Cl2>I2>S D.Cl2>I2>Fe3+>S
8.将氯化银加到溴化钠溶液中,白色不溶物变为淡黄色,把此淡黄色不溶物加到碘化钾溶液中,淡黄色石溶物变为黄色不溶物.此实验方案是为了论证( )
A.活动性:Cl->Br->I- B.还原性:I->Br->Cl-
C.稳定性:AgCl>AgBr>Ag D.溶解性:AgCl>AgBr>AgI
9.通入氯气后,采取必要的措施,可达到除去杂质的目的的是( )
A.氯化钠固体中混有硫酸钠 B.氯化铁溶液中混有氯化亚铁
C.溴水中混有氯气 D.氯化钠溶液里混有溴化钠
10.下列叙述不正确的是( )
A.Cl-→Cl2要加入氧化剂才能实现 B.制溴可以用氧化法也可用还原法
C.铁与氯气反应可直接制出氯化亚铁 D.液氯应放在钢瓶中贮存
11.对于反应:K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,若用0.1molK2Cr2O7参加反应,计算结果是( )
A.被氧化的HCl为1.4mol B.转移电子1.806×1023个
C.还原产物的质量是31.7g D.共消耗密度为1.19g/mL,37%的盐酸116mL
12.在标况下,一个盛满Cl2的烧瓶重62.3g,盛满CO时重60.15g,标况下此烧瓶的容积是( )
A.2.24L B.22.4L C.11.2L D.1.12L
13.甲、乙、丙三种溶液各有一种X-(X-为Cl-、Br-或I-),向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙依次为( )
A.Br-、Cl-、I- B.Br-、I-、Cl- C.I-、Br-、Cl- D.Cl-、I-、Br-
14.氯气跟碘在加热条件下以等物质的量反应可得一红棕色液体ICl,ICl的性质类似卤素,有很强的化学活动性:(1)Zn+2ICl = ZnI2+ZnCl2 (2)ICl+H2O = HCl+HIO,下列叙述中正确的是( )
A.在Zn跟ICl反应中,ZnI2既是氧化产物;又是还原产物
B.在Zn与ICl反应中,ZnCl2既是氧化产物,又是还原产物
C.在H2O跟ICl反应中,ICl是氧化剂,H2O是还原剂
D.在H2O跟ICl反应中,ICl既是氧化剂,又是还原剂
二、计算题
15.将一定量Cl2通入250mLKBr溶液中,反应后将溶液蒸干,测知所得固体中含溴元素10g,且K+与Cl-的物质的量之比为2∶1.试求(1)通入Cl2的体积(标准状况).(2)原KBr溶液的物质的量浓度.
【生活实际运用】
1.由于“智力工程”的推行,“碘盐”已开始进入千家万户.下列关于“碘盐”的叙述中正确的是( )
A.“碘盐”宜密封保存 B.“碘盐”就是“I2+NaCl”
C.“碘盐”就是NaI D.使用“碘盐”时宜高温煎炒
2.变色眼镜的玻璃镜片内含有少量溴化银和微量氧化铜,当玻璃受到阳光照射时,因为发生 反应(用化学方程式表示,下同),而使玻璃由无色变成灰黑色.把玻璃放到暗处,又因为发生 反应,而使玻璃又变成无色透明,在这个变化过程中,CuO的作用是 .
答案 1.A
2.2AgBr![]() 2Ag+Br2
2Ag+Br2
2Ag+Br2 = 2AgBr
催化作用
【知识验证实验】
某化学课外小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)将漏斗上口的玻璃打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(G)静置,分层.
就此实验,完成下列填空:
(1)正确操作步骤的顺序是:(用上述各操作的编号字母填写)
A________EF
(2)上述(E)步骤的操作中应注意 .
(3)能选用CCl4从碘水中萃取碘的原因是______________________________________.
此实践活动要求同学们熟练掌握萃取的原理,掌握萃取和分液的操作方法.
答案:(1)CBDAGEF
(2)使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;使内外空气相通,以保证进行(E)操作时漏斗里液体能够流出.
(3)CCl4与水不互溶,且碘在CCl4中溶解度比在水中大很多.
【知识探究学习】
试举例说明常见物质的分离规律.
解析 物质的分离是指将混和物里几种物质分开,得出几种比较纯净的物质.
分离方法归纳为下表:
| 混合物类型 | 混合物各组分性质 | 分离方法 | 实例 |
| 固态 | 一种组分可溶,另一种不溶 | 溶解、过滤、蒸发、结晶 | NaCl与BaSO4分离 |
| 各组分均可溶,但溶解度随温度变化的差异较大 | 溶解、加热、冷却、结晶 | NaCl与KNO3分离 | |
| 一组分有易升华的性质 | 加热升华 | 碘与砂子分离 | |
| 液态 | 各组分互溶,但沸点不同 | 蒸馏(分馏) | 石油分馏 |
| 溶质在两种互不相溶的溶剂中溶解度不同 | 萃取、分液 | 用CCl4提取碘水中的碘 | |
| 气态 | 各气体与吸收剂作用不同 | 洗气 | CO与CO2分离 |

参考答案:
【同步达纲练习】
一、1.D 2.BD 3.D 4.C 5.AD 6.D 7.B 8.AC 9.D 10.D
二、11.化合态;氟;2F2+2H2O=4HF+O2;HF>HCl>HBr>HI HI>HBr>HCl>HF
12.A:Cl2 B:HBr C:O2 D:H2 E:HCl
三、13.3.8L
【素质优化训练】
一、1.A 2.D 3.B 4.BC 5.BD 6.B 7.A 8.D 9.BD 10.C 11.CD 12.D 13.B 14.A 15.(1)1.4升 (2)1mol/升
