![]()
|
|
学科: 化学 |
| 教学内容:物质的量应用于化学方程式的计算 |
【基础知识精讲】
一、计算物质的量的公式
1.已知m、M,则n=![]()
2.已知标准状况下V、Vm,则n=![]()
3.已知N,NA,则n=![]()
4.已知溶液的c、V,则n=cV
5.已知溶液的m、w、M,则n=![]()
6.已知溶液V、ρ、w、M,则n=![]()
7.已知饱和溶液m、s、M,则n=![]()
二、化学方程式中定量关系
物质在发生化学反应时,参加反应的各粒子之间是按照一定数目进行的.而这些数目的粒子又可以用不同的物理量来表示.例如:
2H2 + O2 ![]() 2H2O(液)
2H2O(液)
化学计量数之比 2 ∶ 1 ∶ 2
分子数目之比 2 ∶ 1 ∶ 2
扩大NA倍 2NA∶NA ∶ 2NA
物质的量之比 2mol∶1mol ∶ 2mol
质量之比: 4g ∶32g ∶ 36g
标况下体积之比:44.8L∶22.4L ∶ 忽略不计
【重点难点解析】
学会正确规范的解题方法
1.解题步骤
(1)根据题意写出正确的化学方程式.
(2)根据化学方程式中化学计量数写出相关物质的物质的量关系(根据需要有时要将有的物质的物质的量转化成质量或体积).
(3)把已知量和要求的量(用x表示)分别写出化学方程式中相关物质下面.
(4)列出比例式,求出未知数.
2.应注意的问题
(1)化学方程式所表示的是纯净物之间的关系,因此不纯物质必须换算成纯净物的量再进行计算.
(2)在所列比例式中,同一物质上下单位要一致,不同物质左右要对应.
(3)化学计算方法很多,其中守恒法、差量法、平均原子量法等在高一应掌握.
过量问题的计算
一般说来,反应物之间完全反应时,不足量的物质会全部反应转化为生成物,而过量的物质则要剩余.因此判断哪种物质过量,便是解这类题的关键.具体步骤为:
1.写出化学反应方程式.
2.判断哪种物质过量.
3.根据不足量求解.
例 用agH2和bgCl2化合制HCl气体,求所得产物的质量.
解析 根据化学方程式列出关系
H2 + Cl2 = 2HCl
2 71
a b
有下列三种情况:
①若71a>2b,则H2过量,应根据Cl2量求HCl的量;
②若2b>71a,则Cl2过量,应根据H2的量求HCl的量;
③若71a=2b,则二者恰好反应完,根据H2或Cl2的量求产物HCl的量.
【难解巧解点拨】
例1 甲、乙两位学生用加热氯酸钾的方法制取O2,甲取一定量的KClO3和0.10gMnO2.经混合后装入试管加热.待收集到所需O2时停止加热.试管冷却后乙称的甲留下的反应混合物的质量为4.04g将它继续加热直到KClO3全部分解完全得到O2672mL(标况).求甲实验时KClO3的分解率.
分析 思路;要求出两个值:一个是总的KClO3质量,一个是甲实验得到的KCl质量而求得甲实验时KClO3分解的质量
做题过程:从后面的结论往前推.
据: 2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
2×122.5g 2×74.5g 3×22.4L
0.672L
知在4.04g混合物中m(KCl)=4.04g-0.10g-![]() =1.49g即甲分解时得到KCl的质量为1.49g,由此可算出甲实验时KClO3的分解质量:
=1.49g即甲分解时得到KCl的质量为1.49g,由此可算出甲实验时KClO3的分解质量:![]() =2.45g
=2.45g
故甲实验时KClO3的分解率为
![]() ×100%=50%
×100%=50%
答:甲实验时氯酸钾的分解率为50%
例2 取50mLNa2CO3和Na2SO4的混合溶液.加入过量BaCl2溶液后得到14.51g白色沉淀.用过量的稀HNO3处理后沉淀减少到4.66g.并有气体CO2放出,试计算(1)原混合溶液中Na2CO3、Na2SO4的物质的量浓度
(2)产生标况下气体的体积.
分析 物质的量和组成物质的微粒间存在着一定的关系利用这种关系会使解题简化我们把这种方法称为“守恒法”它用得很广.
据(1)Na2SO4~ BaSO4 4.66g不溶于HNO3的沉淀为BaSO4
1mol 233g
n(Na2SO4) 4.66g n(Na2SO4)=0.02mol
故 C(Na2SO4)=![]() =0.4mol·L-1
=0.4mol·L-1
(2)Na2CO3 —BaCO3 —CO2
1mol 197g 22.4L
n(Na2CO3) (14.51-4.66)g V(CO2)
n(Na2CO3)=0.05mol V(CO2)=1.12L
C(Na2CO3)=![]() =1mol/L
=1mol/L
答:原混合物中Na2CO3、Na2SO4的物质的量浓度为1mol/L和0.4mol·L-1产生的CO2气体在标况下的体积为1.12L.
【课本难题解答】
P83 三、3 2KBr+Cl2=2KCl+Br2 2KI+Cl2=2KCl+I2
(1)固体残留物中含KCl.
(2)原溶液中n(KI)=36×10-3×0.86=0.031mol,
参加反应的KI有n(KI)=![]() =0.015mol.
=0.015mol.
0.05molKI与Cl2反应生成0.015molKCl,
6.1克KCl的量为![]() =0.082mol,
=0.082mol,
故原KBr的量应为2×(0.082-0.015)=0.134mol,
原KBr的质量为0.134×199=20g.
(3)生成0.082molKCl需Cl2的量为0.014mol,
故反应消耗Cl2的体积为0.014×22.4=0.92L.
【命题趋势分析】
本节高考要求是要学会运用物质的量运用于化学方程式的计算.
【典型热点考题】
例1 完全中和相同体积,相同物质的量浓度的氢氧化钠溶液,并使之生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸的体积比是( )
A.6∶3∶2 B.6∶2∶3 C.3∶2∶1 D.1∶2∶3
解析 此类无数据题目有两种处理方法,一种列举法是把已知条件转化成简单直观的数据;另一种是用相同的化学符号表达已知数据.此题NaOH溶液实为n(NaOH)相同,再设HCl(aq)、H2SO4(aq)、H3PO4(aq)的体积分别为V1、V2、V3,其物质的量浓度为c,则:
NaOH + HCl = NaCl+H2O
1 ∶ 1
n c·V1
V1=![]()
2NaOH + H2SO4 = Na2SO4+2H2O
2 ∶ 1
n c·V2
V2=![]()
3NaOH+H3PO4 = Na3PO4+3H2O
3 ∶ 1
n c·V3
V3=![]()
则V1∶V2∶V3=![]() ∶
∶![]() ∶
∶![]()
=6∶3∶2
∴本题正确选项为(A)
答案 A
例2 往50.00mL溴化亚铁溶液中缓慢通入1120mL氯气(标准状况),溶液中还原性离子只有2/3溴离子未被氧化.求原溴化亚铁溶液的物质的量浓度.
解析 本题应用物质的量对离子方程式进行计算.
根据反应:Br2+2Fe2+ = 2Fe3++2Br-可判断离子的还原性:Fe2+>Br-,依题意,Br-部分被氧化,则Fe2+全部被氧化.
设原溶液中FeBr2的物质的量为x,则Fe2+物质的量为x,Br物质的量为2x,被氧化的Br-的物质的量为2x/3.
2Fe2++ Cl2 = 2Fe3++2Cl-
x x/2
2Br-+Cl2 = Br2+2Cl-
2x/3 x/3
氯气的物质的量:![]() +
+![]() =
=![]() ,
,
解得:x=0.06mol.c(FeBr2)=0.06mol/0.05L=1.2mol/L.
答案 原溴化亚铁溶液的物质的量浓度为1.2mol/L.
例3 已知Cl2在70℃的NaOH水溶液中能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4∶1.现在49.7gCl2,将其通入足量70℃的NaOH水溶液,反应完全后得到500mL溶液.
(1)写出Cl2在70℃的NaOH水溶液中符合上述条件的总反应方程式.
(2)计算完全反应后各生成物的物质的量浓度(除H2O处).
解析 解答此题的关键是第(1)问.可根据得失电子数相等确定生成物NaCl、NaClO、NaClO3的物质的量之比,进而确定化学方程式中化学计算数.
(1)依题意可设生成NaClO的物质的量为4mol,NaClO3的物质的量为1mol,设生成NaCl的物质的量x,根据得失电子的物质的量相等,有:
1×x=1×4mol+5×1mol,解得:x=9mol.
NaCl、NaClO、NaClO3化学计量数之比与生成对应物质的物质的量相等,即等于9∶4∶1.据此可写出总的化学字方程式:
7Cl2+14NaOH = 9NaCl+4NaClO+NaClO3+7H2O
(2)n(Cl2)=49.7g/71g/mol=0.7mol,由化学方程式可求得n(NaCl)=0.9mol,n(NaClO)=0.4mol n(NaClO3)=0.1mol,
故可求得三种物质的量浓度分别为:
c(NaCl)=1.8mol/L;c(NaClO)=0.8mol/L;c(NaClO3)=0.2mol/L.
答案 (1)7Cl2+14NaOH = 9NaCl+4NaClO+NaClO3+7H2O
(2)C(NaCl)=1.8mol/L,Cl(NaClO)=0.8mol/L,C(NaClO3)=0.2mol/L
例4 甲、乙两位学生用加热氯酸钾的方法制取氧气.甲取了一定质量的氯酸钾和0.10g二氧化锰,经混合后装入试管中加热,待收集到所需氧气时停止加热.试管冷却后,乙称得甲留下的反应混合物的质量为4.04g,将它继续加热,直至氯酸钾全部分解,得到氧气672mL(标准状况).求甲实验时氯酸钾分解的百分率.
解析 设乙分解KClO3的质量为x,甲分解KClO3的质量为y.
2KCl3![]() 2KCl+3O2
2KCl+3O2
2mol×122.5g/mol 2mol×74.5g/mol 3mol×22.4L/mol
x 0.672L
![]() =
=![]() ,解得:x=2.45g.
,解得:x=2.45g.
在4.04g混合物中:m(KCl)=4.04g-0.10g-2.45g=1.49g.
即甲分解KClO3时得到的KCl质量为1.49g,由此可计算y:
![]() =
=![]() ,解得:y=2.45g.
,解得:y=2.45g.
故甲实验时KClO3分解的百分率为:![]() ×100%=50%
×100%=50%
答案 甲实验时氯酸钾分解的百分率为50%.
例5 将0.04molKMnO4固体加热一段时间后,收集到amol气体,此时KMnO4的分解率为x.在反应后的残留固体中加入足量的浓盐酸,又收集到bmol气体(设Mn元素全部以Mn2+存在于溶液中).试填写:
(1)a+b= (用x表示).
(2)当x= 时,a+b取最小值,且最小值为 .
(3)当a+b=0.09时,加热后取得残留固体的质量为 g.
解析 解题的关键是正确写出有关化学方程式,并结合数学知识,解决化学问题.
(1)参加分解的反应的KMnO4物质的量为0.04xmol,剩余的KMnO4物质的量为0.04(1-x)mol,根据化学方程式计算.
2KMnO4![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
0.04xmol 0.02xmol 0.02xmol 0.02xmol
2KMnO4+16HCl = 2KCl+2MnCl2+ 5Cl2↑ +8H2O
0.04(1-x)mol 0.1(1-x)mol
K2MnO4+8HCl![]() MnCl2+2KCl+2Cl2↑+4H2O
MnCl2+2KCl+2Cl2↑+4H2O
0.02x 0.04xmol
MnO2+4HCl![]() MnCl2+ Cl2↑+2H2O
MnCl2+ Cl2↑+2H2O
0.02xmol 0.02xmol
a+b=0.02x+0.1(1-x)+0.04x+0.02x=0.1-0.02x.
(2)因为x≤1,当x=1时,a+b有最小值,(a+b)min=0.08.
(3)当a+b=0.09时,0.1-0.02x=0.09,解得:x=0.5.
加热后剩余固体的质量=m(KMnO4)-m(O2)
=0.04mol×158g/mol-0.02×0.5mol×32g/mol=6g.
答案 (1)0.1-0.02x (2)0.08 (3)6g

【同步达纲练习】
一、选择题
1.等质量的下列金属能从足量的稀硫酸溶液中置换出H2最多的是( )
A.铜 B.钾 C.铝 D.铝镁合金
2.完全中和同体积同物质的量浓度的NaOH溶液并使其生成正盐.需相同物质的量浓度的盐酸、硫酸、磷酸的体积比是( )
A.6∶3∶2 B.6∶2∶3 C.3∶2∶1 D.1∶2∶3
3.向10mLNa2SO4溶液中加入过量的BaCl2溶液得到1.17g沉淀.原溶液中Na+的物质的量浓度是( )
A.0.5mol·L-1 B.1.0mol·L-1
C.2.0mol·L-1 D.0.025mol·L-1
4.0.4mol的强酸HxROn+1溶液跟0.8molM(OH)Y溶液恰好中和.则X与Y的比值为( )
A.2∶1 B.1∶2 C.4∶1 D.1∶4
5.在3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O中,当有1.5molCu被氧化时,下列说法正确的是( )
A.有4molHNO3被还原 B.有1molHNO3被还原
C.有6mol电子发生转移 D.有3mol电子发生转移
6.碱金属(LiNaKRb等)溶于水汞中可形成良好的还原剂“汞齐”,取某种碱金属的“汞齐”7g与水作用得到2.24LH2(标况)并得到密度为ρg/cm3的溶液1L1则溶液中溶质的质量分数可以是( )
A. ![]() % B.
% B.![]() % C.
% C.
![]() % D.
% D.
![]() %
%
7.用1L0.1mol/L的NaOH溶液吸收0.08molCO2所得溶液中CO2-3和HCO-3的物质的量浓度之比约为( )
A.1∶3 B.2∶1 C.2∶3 D.3∶2
8.用VmL1mol/AgNO3溶液.都正好与同体积的下列溶液反应完全,则这些溶液物质的量浓度最大的是( )
A.KCl B.CuCl2 C.FeCl3 D.SnCl2
9.0.1molNa2O2、Na2O混合物溶于水后.刚好被100g7.3%的盐酸中和则混合物中Na2O2与Na2O的物质的量之比为( )
A.1∶1 B.2∶1 C.3∶4 D.任意比
10.将1L1.00mol/L的Na2CO3溶液逐滴加入到1L1.25mol/L的盐酸溶液中.再做相反操作:即将1L.1.25mol/L的盐酸逐滴加入1L1.00mol/L的Na2CO3溶液中,两次操作在同温同压下产生的气体体积比是( )
A.2∶5 B.1∶1 C.2∶1 D.5∶2
二、计算题
11.将4.35gMnO2跟50g质量分数为36.5%的盐酸混合加热(不计HCl挥发且MnO2反应完全)试求:
(1)标况下能生产多少升Cl2
(2)有多少摩尔HCl被氧化?
(3)向反应后的溶液中加足量的AgNO3.产生沉淀多少克?
12.某金属硫酸盐8g溶于水后,与适量BaCl2溶液反应,生成不溶于稀盐酸的白色沉淀14g,过滤后,将滤液蒸干,可得该金属的氯化物无水盐0.04mol求:
①该金属的化合价
②该金属的摩尔质量.
13.将1.95gNa2SO4和Na2CO3的混合物溶于水的到溶液A.在A中加入足量一定浓度的BaCl210mL.然后过滤得沉淀B和滤液C,在C中加足量的AgNO3溶液,又生成5.74g沉淀.在B中加入足量稀硫酸,沉淀增加0.180g.计算:
(1)BaCl2溶液的物质的量浓度;
(2)原混合物中Na2SO4的质量分数.
【素质优化训练】
1.0.1mol/LCuSO4、Na2SO4、Al2(SO4)3三种溶液各50mL,若上述三种溶液中SO2-4完全沉淀,所用相同浓度的BaCl2溶液体积比为( )
A.1∶2∶3 B.3∶1∶1 C.6∶3∶2 D.1∶1∶3
2.在两密闭容器中分别盛有31g白磷和1mol氧气,控制条件使其发生如下反应:容器甲:P4+5O2= P4P10,容器乙:P4+3O2= P4O6,经充分反应后,两容器中分别所得的P4O10和P4O6的物质的量之比为( )
A.5∶4 B.4∶5 C.4∶3 D.3∶1
3.两种金属的混合物粉末15g,跟足量盐酸充分反应后,恰好得到11.2LH2(标况),下列各组金属不能构成符合上述条件的混合物是( )
A.Mg和Zn B.Cu和Zn C.Al和Fe D.Mg和Al
4.硫在加热时能被N2O氧化成SO2,现用3.2g硫粉和224mL(标况)N2O在加热条件下充分反应,反应结束后,气体混合物在标况下的体积为( )
A.112Ml B.224mL C.336mL D.448mL
5.0.1mol的某单质跟足量的S反应,反应后质量增加了1.6g,则构成这种单质的元素是( )
A.K B.Fe C.Al D.Na
6.在50g含有1.70g硝酸银和1.85g硝酸钯[Pd(NO3)2]的溶液中加入足量的NaI溶液,充分反应后,静置、过滤、洗涤、干燥,称量得到5.245g固体.由此得出的正确结论是( )
A.银离子只有一部分参加反应 B.钯离子(Pd2+)只有一部分沉淀
C.碘化钯(PdI2)难溶于水 D.碘化钠和硝酸钯在溶液中无沉淀生成
7.下列离子方程式书写不正确的是( )
A.碘化钾溶液中滴入氯水 2I-+Cl2= 2Cl-+I2
B.氯气和水的反应Cl2+H2O= H++Cl-+HClO
C.漂白粉溶液中通入适量的二氧化碳ClO-+CO2+H2O= CO2-3+HClO
D.氯水中滴入硝酸银溶液Cl2+Ag+= 2AgCl↓
8.在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反应中,得电子和失电子的原子个数比为( )
KClO3+5KCl+3H2O的反应中,得电子和失电子的原子个数比为( )
A.5∶1 B.4∶1 C.3∶1 D.2∶1
9.将由CaCO3、MgCO3组成的混合物充分加热至质量不再减小时,称得残留物的质量是原混合物的一半,则残留物中Ca、Mg两元素原子的物质的量之比是( )
A.1∶1 B.1∶2 C.1∶3 D.2∶1
10.12.3gLiNO3·XH2O转变为LiNO3·(X-2)H2O时质量减少3.6g,则X值是( )
A.3 B.4 C.5 D.6
二、计算题
11.将1.95gNa2SO4和Na2CO3的混合物溶于水得到溶液A,在A中加入足量的一定浓度的BaCl2溶液10.0mL,然后过滤得沉淀B和滤液C.在C中加足量AgNO3溶液,又生成5.74g沉淀.向B中加入足量稀硫酸,沉淀增加0.18g.计算:
(1)氯化钡溶液的物质的量浓度;
(2)原混合物中硫酸钠的质量分数.
12.将4.6g金属钠在空气中小心加热,使其燃烧,得到7g燃烧产物.
(1)求燃烧产物中Na2O和Na2O2的物质的量之比.
(2)将燃烧产物全部溶解在18.8g水中,则所得溶液中溶质的质量分数.
13.Na2O2与H2O反应,如果反应中有1mol电子发生转移,则生成O2的物质的量是多少?若所得溶液为1L,求溶液的物质的量浓度.
14.现有2mol/L的盐酸和硫酸溶液各100mL,分别加入等质量的铁,反应后生成的气体在标准状况下的体积比为2∶3,求加入盐酸中的铁的质量.
【生活实际运用】
1.输送氯气的管道为检验其是否漏气,常用浓氨水来检验,试简述其依据的原理.
解析 该过程发生的反应为:
3Cl2+2NH3 = N2+6HCl
HCl+NH3 = NH4Cl
现象及结论 看到白烟,说明有氯气泄漏.
2.无土栽培技术研究需配制一种营养液.1L此营养液应含0.5molNH4Cl、0.16molKCl和0.24molK2SO4.若用KCl、NH4Cl和(NH4)2SO4三种固体物质来配制,则每升溶液需三种固体的物质的量依次是( )
A.0.32mol、0.5mol、0.12mol B.0.02mol、0.64mol、0.24mol
C.0.64mol、0.02mol、0.24mol D.0.16mol、0.5mol、0.24mol
答案 C
【知识验证实验】
如果一个化学过程中涉及到发生了两个以上化学反应,并且这几个化学反应之间存在一定的内在联系(如第一个反应的生成物作为第二个反应中的反应物,依次下去),则同学们可以找出反应起始物质和终了物质之间的物质的量关系,即关系式,通过关系式进行一步计算.
例 工业上常用漂白粉跟酸反应得出的氯气对漂白粉的质量分数(X%)来表示漂白粉的优劣.漂白粉与酸的反应为:
Ca(ClO)2+CaCl2+2H2SO4 = 2CaSO4+2Cl2↑+2H2O
现为测定一瓶漂白粉的x%,进行如下实验:称取漂白粉样品2.00g,加水研磨后转入250mL容量瓶内,用水稀释至得漂刻度.摇匀后,取出25.0mL,加入过量的KI溶液和过量的稀硫酸,静置.待漂白粉放出的氯气与KI完全反应后,加入0.100mol/l的Na2S2O3溶液20.00mL,恰好与生成的碘完全反应:
2Na2S2O3+I2 = Na2S4O6+2NaI
试由上述数据计算该漂白粉的x%.
解析 要计算该漂白粉的x%.
须求出漂白粉与酸作用产生的氯气的质量
由题可知,发生了三个反应
Ca(ClO)2+CaCl2+2H2SO4 = 2CaSO4+2Cl2↑+2H2O
Cl2+2KI = 2KCl+I2
2Na2S2O3+I2 = Na2S4O6+2NaI
则有关系式:Cl2~2Na2S2O3
71g 2mol
y 0.100mol/L×0.02L y=0.071(g)
故2.00g漂白粉样品产生氯气0.071×![]() =0.71(g)
=0.71(g)
所以x%=![]() ×100%=35.5%
×100%=35.5%
答案 X%=35.5%
【知识探究学习】
同学们可以每两个同学组成一个小组,分成若干小组,以“物质的量”的自述为题开一次“自我介绍会”,从物质的量的定义、如何理解物质的量这个基本物理量、物质的量的几种计算方法开展一次活动课.
本章实验总结
一、Cl2、Br2、I2溶解性
Cl2 Br2 I2
水中 黄(溶) 橙(溶) 黄褐(微溶)
CCl4 黄(易溶) 橙红(易溶) 紫红(易溶)
二、碘跟淀粉的反应
①淀粉溶液中加碘水 现象变蓝色
②NaI溶液中加淀粉溶液 无上述现象
说的单质I2遇淀粉溶液变蓝 I-则不能
三、氯、溴、碘之间的置换反应
①湿KI淀粉试纸![]() 变蓝(现象) Cl2+2I-=2Cl-+I2
变蓝(现象) Cl2+2I-=2Cl-+I2
②NaI溶液![]() 黄褐
黄褐![]() 变蓝 Cl2+2I-=2Cl-+I2
变蓝 Cl2+2I-=2Cl-+I2
③NaI溶液![]() 黄褐
黄褐![]() 变蓝 Br2+2I-=2Br-+I2
变蓝 Br2+2I-=2Br-+I2
④NaBr溶液![]() 橙色 Cl2+2Br-=2Cl-+Br2
橙色 Cl2+2Br-=2Cl-+Br2
⑤NaBr溶液![]() 无明显变化
无明显变化
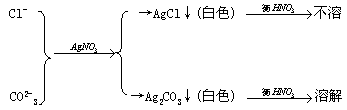
四、Cl-检验

参考答案:
【同步达纲练习】
一、1.C 2.A 3.B 4.A 5.BD 6.AB 7.A 8.A 9.D 10.D
二、11.(1)V(Cl2)=1.12L (2)n(HCl)=0.1mol (3)m(AgCl)=57.4g
12.①+3价 ②56g·mol-1 13.(1)2mol/l (2)72.8%
【素质优化训练】
1.D 2.B 3.B、D 4.C 5.A、D 6.C 7.C、D 8.A 9.C 10.A 11.(1)2mol/升 (2)72.8% 12.(1)1∶1 (2)32% 13.0.5mol 2mol/L 14.8.4g

