广东省佛山新课标高一化学 必修1第三章检测题1
广东省佛山市顺德区罗定邦中学 章自然
一、选择题(每小题只有一个选项符合题意,每小题4分,共32分)
1.钠跟水反应时的现象,与钠的下列性质无关的是( )
A.钠的熔点低 B.钠的密度小
C.钠的硬度小 D.有强还原性
2.某无色溶液中放人铝片后有氢气产生,则下列离子在该溶液中肯定可以大量存在的是 ( )
A。Na+ B.Mg2+
C.OH- D.HCO3-
3.用光洁的铂丝蘸取某无色溶液,在无色灯焰中灼烧时,观察到黄色火焰,下列有关叙述中正确的是( )
A.只有Na+
B.一定含Na+,也可能含K +
C.既有Na+ 又有K+
D.可能含Na+,也可能含K +
4.在空气中能生成致密氧化膜的金属是( )
A.Al B.Cu
C.Fe D. Na
5.区别固体Na2CO3和NaHCO3最好的方法是( )
A.加热
B.两者分别与同浓度的稀盐酸反应
C,溶于水,比较其溶解性
D.两者分别加入NaOH溶液或石灰水
6.下列钠的化合物在自然界中不存在的是( )
A.氧化物 B.硫酸盐
C.氯化物 D.碳酸盐
7.等质量的钠进行下列实验,其中生成氢气最多的是( )
A.将钠投入到足量水中
B.将钠用铝箔包好并刺一些小孔,再放入足量水中
C.将钠放入足量稀硫酸中
D.将钠放入足量稀盐酸中
8.决定金属性强弱的是( )
A.1个金属原子失去电子的多少
B.1 mol金属与酸反应放出氢气的多少
C.1 mol金属失去电子的多少
D.金属原子失去电子的难易程度
二、选择题(每小题有1个或2个选项符合题意,有两个正确选项的,若只选其中一个得2分,选错该小题不得分。每小题4分, 共20分)
9.用来检验Fe3+是否存在的最佳试剂是( )
A.H2S B.NaOH
C.Na2CO3 D.KSCN
10.合金有许多特点,如钠一钾合金为液体,而钠和钾的单质均为固体,据此推测,生铁、纯铁、碳三种物质的熔点最低的是 ( )
A.生铁 B.纯铁
C.碳 D.无法确定
11.将5 g某金属加入到100 mL 2 mol/L的硫酸溶液中,当硫酸浓度降到原浓度的一半时(设溶液体积不变),金属还没有全部溶解。该金属可能是( )
A.Al B.Zn
C.Fe D.Mg
12.足量的盐酸与下列物质反应,得到同温同压下气体体积相同的一组物质是( )
A.等物质的量的Na2CO3和NaHCO3 .
B.等物质的量的Mg和CaCO3
C.等质量的Na和Mg
D.等质量的Na2CO3和NaHCO3
13.下列各组物质中,X是主体物质,Y是少量杂质,Z是要除去杂质而加入的试剂,其中正确的组别是( )
X Y Z
A. FeCl2溶液 FeCl3 KSCN溶液
B. Fe粉 A1粉 NaOH溶液
C. Fe2(SO4)3溶液 FeS04 C12
D. FeCl2溶液 CuCl2 Fe粉
三.填答题(共36分)
14. (5 分)进行焰色反应的操作,应把装在玻璃棒上的( )放在酒精灯的火焰里灼烧,等到跟原来火焰( )的时候,蘸上要检验的溶液,放在火焰上观察火焰的颜色。每次实验完后都要用( )洗净( ),在火焰上灼烧到( )为止。
15. (7分)某研究学习小组在做过氧化钠与水反应实验时,发现过氧化钠与水反应后的溶液滴加酚酞呈红色,但不久红色褪去。甲、乙、丙三个同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以很可能是溶液温度较高使红色褪去。
乙:查阅资料上载“酚酞在浓的碱溶液中因生成三钠盐而呈无色。”实验所加的水较少,红色褪去可能是生成的氢氧化钠溶液浓度较大的影响。
丙:过氧化钠具有强氧化性,生成物中O2 、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
(1) 验证甲是否正确的方法是_________________________
(2) 验证乙是否正确的方法是_________________________
16. (12 分)某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
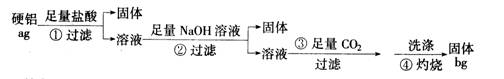
(1) 补全上述①②③④各步反应的离子方程式
① Mg+2H+===Mg2++H2↑ , ___________________________
② _______________________, _______________________
Mg2++OH-===Mg(OH)2↓
③ ___________________________________
CO2+H20+ A102-===Al(OH)3↓+3HCO3-
④2A1(OH)3===Al203+H20
(2)该样品中铝的质量分数是( )
(3)第②步中加入Na0H溶液不足时,会使测定结果( )
第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果( )
第④步对沉淀灼烧不充分时,会使测定结果( )
A.偏高 B.偏低 C.不影响
17. (12分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀H2SO4和______。
(2)除去蒸馏水中溶解的O2常采用____________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下再挤出NaOH溶液。这样操作的理由是_______________________________。
方法二:在如图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
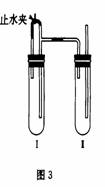
(1)在试管工里加入的试剂是_______________。
(2) 在试管Ⅱ里加入的试剂是_______________。
(3) 为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________________________________________________。
四、计算题(共12分)
18.将镁、铝的混合物0.1 mol溶于100 mL 2 mol/L的H2S04溶液中,然后再滴加1 mol/L的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中,
n(Mg) =( )mol,V2=( )mL。
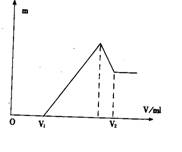
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13 +刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH):=( )mL
第三章检测题(一)答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | A | B | A | B | A | B | D | D | A | AD | AB | BD |
14.铂丝 颜色相同 盐酸 铂丝 没有颜色
15.(1)冷却后加酚酞试液或冷却后看溶液是否变红;
(2)加水稀释后看溶液是否变红
16.(1)2Al+6H+ ===2 A13++3 H2↑ , H++OH-=== H20
A13++ 4OH—===A102-+2H20, CO2+ OH-=== HCO3—
(2)![]()
(3) B,A,A
17.方法一(1)铁屑 (2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2
方法二。(1)稀硫酸,铁屑
(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的氢气的纯净时,再夹紧止水夹
试管Ⅰ中反应生成的氢气充满了试管Ⅰ和试管Ⅱ且外界空气不易进入
18.(1)0.06 440 (2)400
原创