邵阳市二中2006年高一化学期末试题
时量:90分钟 总分:100分 命题、审核:张 戬
可能用到地相对原子质量:H:1 N:14 O:16 Cu:64 P:31 S:32
Na:23 Cl:35.5 Mg:24 AL:27 Fe:56 Si 28
一、选择题(每小题只有一个选项符合题意,3*15共45分)
1、下列物质属于纯净物的是 ( )
A、 盐酸 B、液氯 C、碘酒 D、漂白粉
2、下列变化需加氧化剂才能实现的是( )
A、NH3![]() NH4+
B、N2
NH4+
B、N2![]() NH3
NH3
C、NH3![]() NO
D、Cl2
NO
D、Cl2![]() Cl——
Cl——
3、下列有关反应离子方程式错误的是( )
A、KOH溶液与过量的SO2反应: OH—-+SO2==HSO3—
B、Na2SO3溶液与稀硫酸反应 SO32——+2H+==SO2↑+H2O
C、NaBr溶液中通入氯气:2Br—+Cl2==Br2+2Cl—
D、石灰石与盐酸反应:CO32—+2H+==H2O+CO2↑
4、NA代表阿伏加德常数,下列说法正确的是 ( )
A、在同温同压时,相同体积的任何气体单质所含的原子数目相同
B、17g氨气所含电子数目为10NA
C、在常温常压下,11.2L氮气所含的原子数目为NA
D、2g氢气所含原子数目为NA
5、根据元素周期表的相关知识,试推断以下关于114号元素X的叙述正确的是( )
A、X有稳定的气态氢化物 B、X为非金属元素
C、X的最高价氧化物为XO2 D、X的低价氧化物是酸性氧化物
6、在pH=1的溶液中,可以大量共存的离子是( )
A、K+、Na+、SO42—、S2O32— B、NH4+、Mg2+、SO42—、Cl—
C、Na+、K+、HCO3—、Cl— D、K+、Na+、AlO2—、NO3—
7、下列变化不能通过一步反应实现的是:①Cu→CuSO4 ②SO2→H2SO3 ③SiO2→H2SiO3
④SiO2→Si ⑤Na2CO3→Na2SiO3 ⑥S→SO3 ( )
A、①③⑥ B、③⑥ C、①④⑤ D、②③⑤⑥
8、下列物质中含有非极性共价键的是( )
A、NaOH B、Na2O C、Na2O2 D、CaCl2
9、向50 mL18 mol/L H2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量为 ( )
A、小于0.45 mol B、等于0.45 mol
C、 在0.45和0.90mol 之间 D、 大于0.90mol
10、CO2和NO的混合气体40mL,通过足量的Na2O2固体并充分反应后,同温同压下剩余气体的体积为20mL,则原混合气体中含NO的体积不可能是 ( )
A、10mL B、20mL C、15mL D、30mL
11、下列各组物质的性质及粒子变化正确的是( )
A.酸性:HClO4 >H2SO4>H3PO4>H2CO3
B、稳定性:H2S>HCl>HBr>HI
C、粒子半径:Br—>K+>S2->S
D、还原性:Na>S2->Cl—>Br—
12、下列物质不属于硅酸盐工业产品的是:( )
A、水泥 B、玻璃 C、陶瓷 D、水晶
13、今有下列三个氧化还原反应: ①2FeCl3+2KI==2FeCl2+2KCl+I2
②2FeCl2+Cl2==2FeCl3 ③2KMnO4+16HCl==2KCl+2MnCl2+8H2O+5Cl2↑ 若某溶液中有Fe2+和I——共存,要氧化除去I—-而又不影响Fe2+和Cl——,可加入的试剂是 ( )
A、Cl2 B、KMnO4 C.、FeCl3 D、HCl
14、相同的温度、压强下,三个干燥的烧瓶内,分别收集了一瓶纯净氨气、一瓶空气和氯化氢的混合气(空气和HCl的体积比为1:1),以及一瓶二氧化氮和氧气的混合气(NO2和O2的体积比为4:1),然后分别做喷泉实验;充分溶解后,三个烧瓶中所得溶液的物质的量浓度之比约为( )
A、2:1:2 B、5:5:4 C、1:1:1 D、10:5:8
15、某无色混合气体,依次通过浓硫酸和过氧化钠,气体体积不断减少,颜色变深,则混合气体的组成是 ( )
A、H2O(g)、NO和N2 B、NO2、CO2和H2O(g)
C、O2、HCl和CO D、NH3、NO和CO2
二、填空题(共18分)
16、已知Q与R的摩尔质量之比为9︰22,在反应X+2Y=2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量比为 。
17、A、B、C、均为短周期元素,它们在周期表中的位置如图,
| A | ||
| B | C |
已知B、C两元素在周期表中族序数之和为A元素族序数的2倍;
B、C元素的原子序数之和为A原子序数的4倍,则:
(填元素符号)A ________ B_________ C _________
18、将标准状况下的a L HCl(气)溶于1000g水中,得到的盐酸密度为b g/cm3,则该盐酸的物质的量浓度是 。
19、(4分)配平下列化学方程式:
(1) Cu2S + HNO3== Cu(NO3)2 + H2SO4+ NO↑+ H2O
(2) MnO4 —+ H2O2 H+== Mn2+ + O 2 ↑+ H2O
20、油画所用的颜料含有某种白色铅化合物,置于空气中,天长日久就会生成黑色PbS,从而使油画色彩变暗,若用H2O2来擦拭,则可将PbS转化为白色的PbSO4
而使油画恢复光彩。问:
(1)这一过程的化学方程式:
(2)若有0.1 molPbS参加反应,则此反应中转移的电子总数为 mol
三、推断题:(共16分)
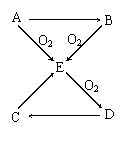 21、(10分)已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),
21、(10分)已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),
且五种物质中均含有A元素。
(1)若A为固体单质,则①D的分子式为 ,
② C→E的化学方程式为
③ 将E通入某些单质的溶液中,可发生反应生成两种强酸,试举一例写出化学方程式 。
(2)若A为气体单质,则
① D→C的化学方程式
② C→E的离子方程式为 。
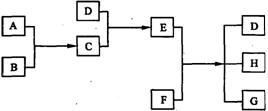 22、(8分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
22、(8分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
(1)D的化学式(分子式)是 ,E的化学式(分子式)是 。
(2)A和B反应生成C的化学方程式是 。
(3)E和F反应生成D、H和G的化学方程式是 。
四、实验题(共9分)
23、(9分)为验证木炭与浓硫酸反应生成的气体M含有CO2和SO2,可按下图进行实验。各装置中可供选择的试剂是:①澄清石灰水,②品红溶液,③酸性高锰酸钾溶液。判断各装置所盛试剂后,请回答:
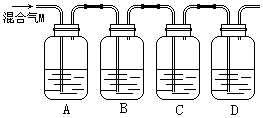
(1)A中所盛放的试剂是_____ _(填写试剂序号),现象是 ,
说明了 ________ 。
(2)B中的实验现象_____________,B装置的作用是 。
(3)C中所盛试剂的作用_________,C装置的作用是 _ 。
(4)D中所盛试剂应为 ___ ,作用是 ________ 。
高一化学答题卡
姓名 班级 考号
一、选择题:(每题3分,共45分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
二、填空题(20分 每空2分)
16、 。 17、 、 、 。
18、 、
19、(4分)配平下列化学方程式:
(1) Cu2S + HNO3== Cu(NO3)2 + H2SO4+ NO↑+ H2O
(2) MnO4 —+ H2O2 H+== Mn2+ + O 2 ↑+ H2O
20、(1)化学方程式: 。
(2) mol。
三、推断题:(共16分)
21、(1)D的分子式为 ,
② C→E的化学方程式为
③ 将E通入某些单质的溶液中,可发生反应生成两种强酸,试举一例写出化学方程式 。
(2)若A为气体单质,则
① D→C的化学方程式
② C→E的离子方程式为 。
22、(1)D的化学式(分子式)是 ,E的化学式(分子式)是 。
(2)A和B反应生成C的化学方程式是 。
(3)E和F反应生成D、H和G的化学方程式是 。
四、实验题(共9分24、25、26、27、
23、(1)A中所盛放的试剂是_____ _(填写试剂序号),现象是 ,
说明了 ________ 。
(2)B中的实验现象_____________,B装置的作用是 。
(3)C中所盛试剂的作用_________,C装置的作用是 _ 。
(4)D中所盛试剂应为 ___ ,作用是 ________ 。
五、计算题(共12分)
24、(4分)硅与烧碱溶液反应的化学方程式为:Si+2NaOH+H2O== Na2SiO3+2H2↑。试计算7g纯硅与足量烧碱溶液反应,放出的氢气在标准状况下有多少升?生成的溶液加入足量的盐酸,再将生成的沉淀经高温灼烧,可得固体物质多少克?
25、(8分)将32.64g铜与140mL一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为1.12L,求:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmL amoL/L的NaOH溶液,恰好使溶液中的铜离子全部转化成沉淀,则,原硝酸溶液的浓度为 moL/L。
(3)欲使铜与硝酸反应产生的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
附加题:(共10分)
26、在以氯气消毒的饮用水中,含有微量对人体有潜在危害作用的含氯化合物。世界环保联盟即将全面禁止自来水中加氯气,推广采用广谱高效杀菌消毒剂
![]() (黄色气体)。
(黄色气体)。
(1)实验室将氯酸钠和亚硫酸钠分别倒入烧瓶中,滴入硫酸,水浴加热即可制得 ![]() 。写出该反应的化学方程式______________________________________________。
。写出该反应的化学方程式______________________________________________。
(2)目前欧洲和我国主要采用Kesting(原料为氯酸钠和盐酸)制取
![]() ,该法的缺点是同时产生
,该法的缺点是同时产生
![]() (占
(占
![]() 体积的一半),使产品的纯度低。写出该法制取
体积的一半),使产品的纯度低。写出该法制取
![]() 的化学方程式______________________________________________。
的化学方程式______________________________________________。
(3) ![]() 和
和
![]() 都是通过氧化作用来杀菌消毒的,试计算相同质量时,
都是通过氧化作用来杀菌消毒的,试计算相同质量时,
![]() 的氧化能力是
的氧化能力是
![]() 的多少倍?
的多少倍?
邵阳市二中2006年高一化学期末试题
参考答案
一、选择题:(每题3分,共45分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | C | D | B | C | B | B | C | A | D | A | D | C | B | D |
二、填空题(共20分 每空2分)
16、 16︰9 17、O;P;CL 18、![]()
19、(1) 3 Cu2S + 22 HNO3== 6 Cu(NO3)2 + 3 H2SO4+ 10 NO↑+ 8 H2O
(2) 2 MnO4 —+ 5 H2O2 6 H+== 2 Mn2+ + 5 O 2 ↑+ 8 H2O
20、PbS+4H2O2====PbSO4+4H2O
(黑色) (白色)
三、推断题:(共16分)
21、(1)①SO3 ②Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O ③SO2+Cl2+2H2O=2HCl+H2SO4
(2)①3NO2+H2O=2HNO3+NO ②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
22、(1)NH3 NH4Cl
(2)H2+Cl2![]() 2HCl
2HCl
(3)2NH4Cl+Ca(OH)2![]() 2NH3↑+2H2O+CaCl2
2NH3↑+2H2O+CaCl2
四、实验题(共9分)
23、(1)② 品红褪色 气体中含SO2
(2)③ 除去SO2气体 (3) ① 检验CO2气体的存在
(4)碱液(如NaOH溶液等) 吸收多余的尾气
五、计算题(共10分)
24、11。2L 15g 25、 5.8 L; 5.4 L;( aVx10—3+0.5)/0.14; 57.8 g。
解析:(1)氯酸钠和亚硫酸钠在加入硫酸时发生反应生成 ![]() ,
,
![]() 中氯元素是+4价,在反应中氯元素的化合价降低了,根据氧化还原反应规律,必有元素化合价升高了,在反应中只能是亚硫酸钠被氧化成硫酸钠,因此发生反应的化学方程式可表示为:
中氯元素是+4价,在反应中氯元素的化合价降低了,根据氧化还原反应规律,必有元素化合价升高了,在反应中只能是亚硫酸钠被氧化成硫酸钠,因此发生反应的化学方程式可表示为:
![]()
![]()
![]()
(2)在用氯酸钠和盐酸反应制取 ![]() 时,产生的
时,产生的
![]() 占
占
![]() 体积的一半,也就是说在产物中
体积的一半,也就是说在产物中
![]() 和
和
![]() 的物质的量之比为2 :1,反应中氯酸钠应为氧化剂,盐酸应为还原剂,反应的化学方程式为:
的物质的量之比为2 :1,反应中氯酸钠应为氧化剂,盐酸应为还原剂,反应的化学方程式为:
![]()
(3)比较相同质量时 ![]() 和
和
![]() 的杀菌消毒能力,就是比较在相同质量时它们都转化为
的杀菌消毒能力,就是比较在相同质量时它们都转化为
![]() 时得到电子数目的多少,一个
时得到电子数目的多少,一个
![]() 分子转为
分子转为
![]() 时要得到5e-,一个
时要得到5e-,一个 ![]() 分子转化为
分子转化为
![]() 时要得到2e-,由此可以推断除相同质量时它们的氧化能力之比为:
时要得到2e-,由此可以推断除相同质量时它们的氧化能力之比为:
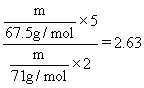
答案:(1) ![]()
![]()
![]()
(2) ![]()
(3)2.63