高一上学期期中阶段评估
一、选择题(每小题只有1个正确选项)
1.在氧化还原反应中,下列说法正确的是( )
A.失去电子被氧化,发生了氧化反应,该物质是氧化剂
B.氧化剂被氧化,还原剂被还原
C.氧化剂得到电子被还原,其产物为氧化产物
D.得到电子的物质被还原,元素化合价降低,表现氧化性
2.下列四种物质的溶液中,所含微粒种类最多的是( )
A.盐酸 B.硫酸
C.氢氧化钡 D.醋酸
3.下列反应既是离子反应又是氧化还原反应的是( )
A.BaCl2溶液中滴入稀H2SO4
B.盐酸和氧化镁
C.铁片放入CuSO4溶液中
D.氢气还原氧化铜
4.碱金属的原子结构和单质按Li、Na、Rb、Cs顺序依次增大的是( )
①熔点 ②密度 ③化学活动性 ④还原性 ⑤电子层数 ⑥原子半径 ⑦阳离子氧化性 ⑧阳离子半径 ⑨最外层电子数 ⑩最高化合价
A.②③④⑤⑥⑧ B.①②③④⑤⑥⑦⑧
C.③④⑤⑥⑧ D.③④⑤⑥⑦⑨⑩
5.向紫色石蕊溶液中加过氧化钠粉末,充分搅拌后,最后溶液的颜色为( )
A.红色 B.蓝色
C.紫色 D.无色
二、选择题(每小题有1~2个正确选项)
6.对下列物质的叙述,不正确的是( )
A.金属钠具有强还原性
B.二氧化碳在一定条件下具有氧化性
C.氧气通常具有氧化性而不具有还原性
D.盐酸只具有氧化性
7.需要加入氧化剂才能实现的变化是( )
A.Cl-→Cl2 B.ClO3-→Cl-
C.![]() D.CO32-→CO2
D.CO32-→CO2
8.下列反应的离子方程式正确的是( )
A.大理石和硝酸:CO32-+2H+==H2O+CO2↑
B.铁和稀盐酸:2Fe+6H+==2Fe3++3H2↑
C.稀硫酸和氨水: H++NH3·H2O==NH4++H2O
D.碳酸氢钙和盐酸:HCO3-+H+==H2O+CO2↑
9.下列各组离子在溶液中能大量共存的是( )
A.K+,Na+,Cl-,CH3COO-
B.Na+,Ba2+,NO3-,SO42-
C.Ca2+,Cl-,K+,SO42-
D.K+,CO32-,H+,SO42-
10.用一种试剂区别NaOH,Ba(OH)2,稀H2SO4三种溶液,这种试剂是( )
A.石蕊试液 B.Na2CO3溶液
C.NaHCO3溶液 D.Ba(NO3)2溶液
11.下面关于钠的叙述正确的是( )
A.钠是活泼金属,将钠放入FeCl3溶液中可将铁置换出来
B.钠的原子半径小于钾的原子半径,钠离子的半径小于钾离子半径
C.钠是一种易燃物质,在氧气中点燃可生成白色固体Na2O
D.把2.3克钠投入97.7克水中,充分反应后,溶液质量分数大于4%
12.下列物质放入酚酞试液不能使酚酞试液变红的是( )
A.金属钠 B.氧化钠
C.过氧化钠 D.氢氧化铁
13.关于铷的性质或用途中不正确的是( )
A.单质与水反应发生爆炸
B.单质的熔点比钾高
C.氢氧化物的碱性比氢氧化钾要弱些
D.单质为银色
14.泡沫灭火机内装的药液之一是NaHCO3饱和溶液,而不选用更廉价的Na2CO3饱和溶液,其原因是( )
①质量相同的两种钠盐,NaHCO3与足量酸反应产生的CO2比Na2CO3多
②产生相同体积(同温,同压)的CO2,消耗酸的量NaHCO3比Na2CO3少
③NaHCO3与酸反应比Na2CO3快得多
④NaHCO3比Na2CO3稳定,便于长期保存
A.只有①③ B.只有②③
C.①②③ D.①②③④
15.用光洁的铂丝蘸取某无色溶液,在无色火焰上加热直接观察到火焰呈黄色,有关叙述正确的是( )
A.一定只含Na+
B.一定含有Na+,还可能含有K+
C.既含Na+又含K+
D.可能含有Na+或K+
三、选择题(每小题只有1个正确选项)
16.根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O==2HI+H2SO4
②2FeCl3+2HI==2FeCl2+2HCl+I2
③3FeCl2+4HNO3==2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO
B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO4>NO
D.NO>Fe2+>H2SO3>I-
17.向一定体积的澄清石灰水中不断通入CO2溶液的导电性(以电流I表示)和通入的CO2的体积(用V表示)间关系正确的是( )

18.下列变化可以一步实现的是( )
A.NaHCO3→Na2O B.NaNO3→NaCl
C.Na2CO3→NaOH D.Fe(OH)3→NaOH
19.将含杂质的4.0克NaOH配成1000mL溶液,取20mL置于锥形瓶中与HCl质量分数为0.365%的盐酸反应,恰好消耗19.0克盐酸,则NaOH中含有杂质不可能是( )
A.Na2SO4 B.Na2CO3
C.NaHCO3 D.Ca(OH)2
20.16.8gNaHCO3和7.8克Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃,最后容器内物质是( )
A.Na2CO3,Na2O,O2
B.Na2CO3,O2,H2O(g)
C.Na2CO3,CO2,O2,H2O(g)
D.NaHCO3,Na2CO3,O2
四、填空题
21.化学反应的过程,从能量变化的角度可以看成是_______________或者是_______________的过程。
22.选择符合下列问题的化学反应,把下列反应方程式的编号填入括号内:①属于既不是分解反应,又不是氧化还原反应的是( );②属于既是分解反应,又是氧化还原反应的是( );③只属于氧化还原反应的是( );④只属于化合反应不属于氧化还原反应的是( )
A.Ca(HCO3)2![]() CaCO3+H2O+CO2↑
CaCO3+H2O+CO2↑
B.2H2+O2![]() 2H2O
2H2O
C.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
D.CaCO3+2HCl==CaCl2+H2O+CO2↑
E.CaO+CO2==CaCO3
F.Cl2+2KI==2KCl+I2
G.2Na2O2+2H2O==4NaOH+O2↑
23.已知①H2SO4(浓)+2HBr![]() SO2↑+Br2↑+2H2O
SO2↑+Br2↑+2H2O
②2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O
③5Br2+2P+8H2O==10HBr+2H3PO4
④NaCl(固)+H2SO4(浓)![]() NaHSO4+HCl↑
NaHSO4+HCl↑
判断H2SO4(浓),KMnO4,H3PO4,Br2四种物质的氧化能力强弱________________
24.按要求写出下列反应的方程式,是氧化还原反应的,标出电子转移的方向和数目。
①Na与FeCl3溶液反应:(写化学方程式)
②Na2O2与CO2反应(写化学方程式)
③Ba(OH)2溶液与CuSO4溶液(写离子方程式)
④Ca(HCO3)2溶液与NaOH溶液(适量和过量)(写离子方程式)
五、实验题
 25.工业纯碱主要成份是无水碳酸钠,其中还含少量氯化钠,为测定工业纯碱中碳酸钠的质量分数:某学生设计了如下图的装置:
25.工业纯碱主要成份是无水碳酸钠,其中还含少量氯化钠,为测定工业纯碱中碳酸钠的质量分数:某学生设计了如下图的装置:
操作程序是:1.准确称取盛有碱石灰的干燥管的质量(m1g),再准确称取一定质量纯碱mg并全部放入a中;2.组装全部反应装置并检查气密性,关闭d;由e逐滴加入稀硫酸至不再产生气泡为止;3.打开d,慢慢鼓入空气10min;4.再称干燥管的总质量为m2g。
①必须鼓入空气的理由是______________________________。
②不设置装置C将使测定结果______(填偏大、偏小或不变),原因是____________________________。
③不设置b 将使测定结果______(填偏大、偏小或不变),原因是_____________________________。
④Na2CO3质量分数的计算式为__________________________。
六、计算题
27. Na2CO3和NaHCO3混合物9.5g加入稀盐酸,到不再产生气体为止,恰好用去50克稀盐酸,将生成的气体通入过量的石灰水中,得到沉淀10g,求①混合物中Na2CO3与NaHCO3各多少克?②所用稀盐酸的溶质质量分数。③所得溶液溶质质量分数。
28.取6.60克NaHCO3和Na2O2的固体混合物,在密闭容器中加热到250℃经充分反应排出气体,冷却后称得固体质量为5.30克,计算原混合物中Na2O2的质量分数。
参考答案
高一上期中
1.D 2.D 3.C 4.A 5.D 6.D
7.A 8.C、D 9.A 10.B、C 11.B、D 12.D 13.B、C 14.C 15.B 16.A
17.A 18.C 19.C、D 20.B
四.填空题
21.“贮存”在物质内部的能量转化为热能等而被释放出来;热能等转化为物质内部的能量而被“贮存”起来的过程。
22.①D、E ②C ③G ④E
23.KMnO4>H2SO2(浓)>Br2>H3PO4
![]() 24.
得6×e-
24.
得6×e-
![]() ①6Na+6H2O+2FeCl3==2Fe(OH)3+6NaCl+3H2↑
①6Na+6H2O+2FeCl3==2Fe(OH)3+6NaCl+3H2↑
失6×e-
![]() 得2×e-
得2×e-
![]() ②2Na2O2+2CO2==2Na2CO3+O2
②2Na2O2+2CO2==2Na2CO3+O2
失2×e-
③Ba2++2OH-+Cu2++SO42-==Cu(OH)2↓+BaSO4↓
④NaOH适量:Ca2++HCO3-+OH-==CaCO3↓+H2O
NaOH过量:Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-
五.实验题
25、①将残留在a瓶,C试管和导管中CO2排出,使之全部被碱石灰吸收。
②偏大;水蒸气也被碱石灰吸收。
③偏大;空气中CO2也被碱石灰吸收。
④![]()
六.计算题
26.解析:①设与过量石灰水反应的CO2的质量为x
CO2+Ca(OH)2==CaCO3↓+H2O
44 100
x 10g x=4.4克
设混合物中Na2CO3的质量为y,NaHCO3的质量为z
Na2CO3+2HCl==2NaCl+H2O+CO2↑ NaHCO3+HCl==NaCl+H2O+CO2↑
106 44
由题意可知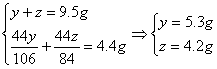
答:混和物中Na2CO3为5.3g,NaHCO34.2g
②设与Na2CO3和NaHCO3反应的HCl的质量分别为A和B,同时生成的NaCl的质量分别为A’和B’
Na2CO3+2HCl==2NaCl+H2O+CO2↑ NaHCO3+HCl==NaCl+H2O+CO2↑
106 73 117 84 36.5 58.5
5.3g A A’ 4.2g B B’
A=3.65g A’=5.85g B=1.825g B’=2.925g
ω(HCl)
=![]()
③ω(NaCl)
=![]()
27.解:2NaHCO3![]() Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
2Na2O2+2CO2==2Na2CO3+O2
2Na2O2+2H2O==4NaOH+O2
假设NaHCO3分解放出的CO2恰好能与Na2O2反应,设固体质量减少的质量为x即
![]() 4NaHCO3+2Na2O2==4Na2CO3+2H2O+O2 Δm
4NaHCO3+2Na2O2==4Na2CO3+2H2O+O2 Δm
492 36+32=68
6.6g x
x=0.91g
由于0.91g<6.60-5.30=1.30g
所以NaHCO3过量,即固体全部为Na2CO3
设NaHCO3的质量为y,Na2O2的质量为z

(Na原子守恒)
∴ω(Na2O2)=![]()
答:原混合物中Na2O2的质量分数为23.6%。
高一上期末
1.C 2.A 3.C 4.B 5.D 6.D 7.B 8.C 9.B 10.D 11.D 12.B、D 13.C 14.A、C 15.D 16.C 17.C、D 18.B、C 19.C 20.D
21.91.8g
22.(1)Cl2;Cl2+2Br-=2Cl-+Br2
(2)Cl-;Cl-+Ag+=AgCl↓
(3)H+;HclO
23. K;1mol;
24.(1)直接加热
(2)加入过量盐酸后加热
(3)通过饱和碳酸氢钠溶液后再干燥
(4)溶于水后再过滤,将滤液浓缩结晶.
25.A.NaOH; B.HCl ; C.NaHCO3、D.Ca(HCO3)2 E.K2CO3、、、
26(1)①②④③⑤;
(2)天平、烧杯、玻璃棒、500 mL容量瓶、胶头滴管;
(3)偏低;
(4) 偏低;偏低
27.(1)11.9mol·L-1
(2)0.85mol
28.(1) Na2CO310.6g;NaHCO316.8g
(2)4 mol·L-1
(3)6.72L