重庆市垫江师范2005-06学年度高一化学上学期
期中考试试卷
该试卷内容为高一化学第一章至第三章,试卷难度较大,灵活性较强,适合于重点中学的学生或实验班的学生。人教版教材(必修)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共四大题24个小题。考试时间90分钟,满分100分。
2.认真分析,仔细审题;答题要求规范,卷面整洁。
3.务必在第II卷在指定的地方写姓名、考生号,并必须用黑色字迹的钢笔或签字笔作答,选择题答案写在题号后答题框内. 非选择题答案直接写在题卷上.( 即各题目指定区域内相应位置上)。
4.可能用到的相对原子质量:H:1 C:12 O:16 S:32 Na:23 N:14 Cl:35.5 K:39
第I卷(选择题,共54分)
一、 选择题(本题包含18个小题,每小题3分,共54分。每小题只有一个选项符合题意。)
1.“化学——人类进步的关键”是( )在美国化学会成立100周年大会上的讲话。
A、爱因斯坦 B、诺贝尔 C、居里夫人 D、西博格
2.下列反应中,属于氧化还原反应的是
A. CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O B. CaO + H2O = Ca(OH)2
C. 2KMnO4 ![]() K2MnO4 + MnO2
+ O2↑ D. CaCO3
K2MnO4 + MnO2
+ O2↑ D. CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
3.在医疗上,治疗胃酸过多可服用下列药剂
A.NaOH B。CaCO3 C.Na2CO3 D.NaHCO3.
4下列各种方法中,可以用于除去苏打中混有的少量小苏打的是
A.水洗 B. 加热 C. 通入CO2 D. 加入盐酸
5、下列叙述错误的是( )
A、1摩尔任何物质都含有约6.02×1023个原子 B、0.012kg12C含有阿伏加德罗常数个碳原子
C、在使用摩尔表示物质的量时,必须指明粒子的种类
D、在化学反应中某元素由游离态转化为化合态,则该元素在变化中既可能被氧化又可能被还原
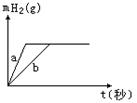 6.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图所示,则下列说法中正确的是
6.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图所示,则下列说法中正确的是
A.投入的Na、K一定等质量 B.投入的Na的质量大于K的质量 C.曲线a为K,b为Na D.稀盐酸的量一定是不足量的
7.下列叙述正确的是
A. 做焰色反应实验后,要用稀硫酸洗净铂丝
B. 托盘天平的精确度为0.1克,量筒的精确度为0.01毫升
C.玻璃棒在过滤中的作用是引流,在蒸发溶液时是搅拌
D. 容量瓶上标有温度和容积, 用容量瓶溶解固体时,加热可加速固体的溶解
8.、下列反应既是氧化还原反应,又可用离子方程式表示的是
A.醋酸和苛性钠溶液 B. 铁和氯化铜溶液 C. 氢气还原CuO D. 加热高锰酸
9.同温同压下,甲容器中HCl气体和乙容器中的NH3气所含的原子个数相等,则甲、乙两容器的体积之比为
A、2:1 B、1:2 C、1:1 D、1:4
10、若NA为阿伏加德罗常数, 则下列叙述正确的是
① 2L1mol/L CaCl2溶液中, 离子总数为3NA ②4℃时2.7mL的水所含的分子数为0.15NA
③标准状况下, 22.4L氢气所含的中子数为2NA ④在74.5g氯化钾中含有NA个K+离子
A.①② B.③④ C.①③ D.②④
11.下列四种基本类型的反应①化合反应,②分解反应,③置换反应,④复分解反应,能产生二氧化碳的是
A只有①②③ B.只有②③④ C.只有①③④ D.①②③④
12.下列各组离子,能在溶液中大量共存的是
A.K+ 、H+ 、SO42- 、OH– B. Na+ 、Cu2+ 、Cl - 、SO42-
C.Na+ 、H+ 、Cl - 、CO32 - D. Na+ 、Ca2+ 、CO32- 、NO3-
13. 造纸工业常用 ![]() 漂白纸浆。漂白后的纸浆要用
漂白纸浆。漂白后的纸浆要用
![]() 除去残留的
除去残留的
![]() ,其反应为:
,其反应为:![]() 在这个反应中,氧化产物与还原产物的物质的量之比是 A.1:1 B。2:1
C。1:2 D。2:3
在这个反应中,氧化产物与还原产物的物质的量之比是 A.1:1 B。2:1
C。1:2 D。2:3
14.下列说法正确的是
A化石燃料在任何条件下都能充分燃烧 B. 氧化还原反应中一定有元素化合价发生变化
C.有氧元素参加的反应一定是氧化还原反应 D. 阴离子都是还原剂
15下列反应既属于氧化还原反应,又是吸热反应的是
A. 铝片与稀硫酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的碳与CO2的反应 D. 甲烷在氧气中燃烧
16已知在某温度下发生如下三个反应:
①
C+CO2![]() 2CO ② C+H2O
2CO ② C+H2O![]() CO+H2
③ CO+H2O
CO+H2
③ CO+H2O![]() CO2+H2
CO2+H2
由此可以判断,在该温度下C、CO、H2的还原性强弱顺序是
A.CO>C>H2 B.C>CO>H2
C.C>H2>CO D.CO>H2>C
17、下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质(生成的产物)并不改变的是
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.木炭(C)和O2
18、如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中NA为阿伏加德罗常数)
A.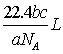 B.
B. C.
C. D.
D.
 重庆市垫江师范2005—06学年度高一上学期化学期中考试
重庆市垫江师范2005—06学年度高一上学期化学期中考试
高一年级化学试卷成绩统计表(考生不要填写)
| 题
号 | 一 | 二 | 三 | 四 | 总 分 | |||
| 19 | 20 | 21 | 22 | 23 | ||||
| 得 分 |
|
|
|
|
|
|
| |
第I卷答题栏(选择题,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
二、填空题(本题包括3小题,共22分).
19 A.(3分)现有以下物质:①氮气 ②液态CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaOH溶液, 请回答下列问题(填序号):
(1)以上物质能导电的是 ,。
(2)以上物质中属于电解质的是 ,
(3)以上物质属于非电解质的是 。
B、(3分) 在进行有关燃料充分燃烧的条件讨论时,有两种意见:甲同学认为:空气越多越好,乙同学认识:空气足量即可.你认为上述哪一位同学的意见是不正确的?理由是什么?答__________ , ______________________________________
C、(4分)用双线桥表示下列反应中得失电子的情况,并指明氧化剂、还原剂、氧化产物、还原产物:
3FeO + 10HNO3 == 3Fe(NO3)3 + NO↑ + 5H2O.
 20.A(1分)写出符合离子方程式Ba2++SO42- =BaSO4↓的一个化学方程式是
。
20.A(1分)写出符合离子方程式Ba2++SO42- =BaSO4↓的一个化学方程式是
。
B.(3分)下图表示的是往某![]() 溶液中
溶液中
![]() 滴入稀盐酸产生CO2的过程。
滴入稀盐酸产生CO2的过程。
(1)写出![]() 点以前发生反应的离子方程式
。
点以前发生反应的离子方程式
。
(2)写出![]() 点到
点到![]() 点发生反应的离子方程式
。
点发生反应的离子方程式
。
![]()
![]() (3)若某
(3)若某![]() 溶液中含
溶液中含![]()
![]()
![]() ,向其中滴入一定量的稀盐酸,恰好使溶液中
,向其中滴入一定量的稀盐酸,恰好使溶液中![]() 和
和![]() 的物质的量之比为2:1,则滴入稀盐酸的物质的量等于
的物质的量之比为2:1,则滴入稀盐酸的物质的量等于
![]() (用
(用![]() 表示)。
表示)。
21(8分)碱金属元素的原子最外电子层均有________个电子,在化学反应中容易________电子,形成________离子.它们的单质都有________性.随着核电荷数增加,碱金属原子的电子层数依次________,原子半径依次________,原子核对外层电子的引力逐渐________,所以它们的金属性________. 若以R代表碱金属元素,则其氢氧化物的通式为___________________,在水溶液中显碱性。含有两个电子层的碱金属是____,通常保存在_________中;由于钠___________________________________,因此钠通常保存在____________中。
三、实验与推断(本题包括2小题,共14分)
22、Ⅰ、(8分)用浓H2SO4(质量分数为98%、密度为1.8g/cm3)配制500mL3.6mol/L的稀H2SO4,回答下列问题:
(1)该实验中所用的实验仪器除了烧杯、量筒、玻璃棒以外,还需要的仪器有_______________。
(2)该实验中的部分操作如下:
A、用量筒量取一定量浓H2SO4
B、将所取的浓H2SO4注入烧杯中,并加入适量水溶解
C、将溶解后的硫酸沿玻璃棒立即转入500mL容量瓶中
D、洗涤烧杯2—3次,并把洗涤液沿玻璃棒注入容量瓶中
所取浓H2SO4的体积为______________________mL;
上述操作有明显错误的有(填字母编号)___________________________。
(3)下列操作会使所配H2SO4溶液浓度偏低的有___________。
A、所用容量瓶底部有少量蒸馏水 B、定容时俯视刻度线
C、定容时仰视刻度线 D、洗涤烧杯的溶液没有转入容量瓶中
II(6分)在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图2-3所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止。
(1)装置B的淡黄色粉末是:_____,干燥管 C中的白色固体应为_____;
(2)A中发生的化学反应方程式___________________________
(3)B中发生的化学反应方程式___________________________
四、计算题(本题包括2小题,共10分)
23、(4分)49 g硫酸的物质的量为________mol,若在水中完全电离可产生________mol ![]() ,________mol
,________mol ![]() .若有一定量的硫酸完全电离产生
.若有一定量的硫酸完全电离产生![]() 个
个![]() ,此硫酸的质量为________g.
,此硫酸的质量为________g.
24.(6分)在标准状况下,将224 L![]() 气体溶于635 mL(
气体溶于635 mL(![]() )的水中,所得盐酸的密度为1.20
)的水中,所得盐酸的密度为1.20![]() ,试求:(1)该盐酸的物质的量浓度
,试求:(1)该盐酸的物质的量浓度
(2)标准状况下,取这种盐酸100 mL与足量的![]() 溶液反应后,放出多少升气体?气体干燥后,通过盛有足量
溶液反应后,放出多少升气体?气体干燥后,通过盛有足量![]() 固体的容器,充分反应后,容器内固体增重多少克?
固体的容器,充分反应后,容器内固体增重多少克?
解:
重庆市垫江师范2005—2006学年度上学期期中考试
高一年级化学参考答案
一、选择题(本题包含18个小题,每小题3分,共54分。)
DCDBA CCBAD DBCBC BCA
二、(本题包括3小题,共22分)
19.A(3分).(1)4、8、9 (2)3、5、8 (3)2、6、7(各1分)
B (3分)甲不对(1分).
因为过量空气会带走部分热量,同样会造成资源的浪费.(2分)
C.(4分 )
 失去3e-
失去3e-
3FeO + 10HNO3 ==3Fe(NO3)3 +NO↑ + 5H2O
得到3e-
还原剂 氧化剂 氧化产物 还原产物、
20.A(1分)、(合理答案均可)
B.(共3分)(1)![]()
(2)![]() ((3)
((3)![]() (每个1分)
(每个1分)
21.(8分)1,失,阳,还原,增加,增大,减小,增强
ROH 锂(Li) 液态石蜡 容易与空气中的水蒸气和氧气反应而变质(1分) 煤油(其余0.5/空)
三、(本题包括2小题,共14分)
22.A(8分)(1)500mL容量瓶 胶头滴管
(2)10.0 B、C
(3)C、D (每空2分)
B(6分) Na2O2 无水硫酸铜,CaCO3+2HCl====2CaCl2+CO2↑+H2O
2Na2O2+2CO2====2Na2CO3+O2 Na2CO3
四、(本题包括2小题,共10分)
23(4分)0.5,1,0.5,147
24(6分)(1)12.0 ![]()
(2)26.9L;33.6g
| |
(2005-11-15)