高一化学第二章检测题
一、 选择题
( )1、下列有关的化学性质叙述中,正确的是
(A)钠与水剧烈反应生成氢氧化钠和氢气
(B)钠在空气里燃烧生成过氧化钠白色固体
(C)金属钠在自然界中可以游离态存在
(D)钠与氯气反应,产生白雾。
( )2、金属钠在空气中长久放置,最终生成物是
(A)Na2O2 (B)Na2O (C)Na2CO3 (D)NaOH
( )3、将a g金属钠投入到b g水中(水过量),反应后所得溶液的质量分数是
(A)a/(a+b) ´100% (B)40a/ (a+b) ´100%
(C)20a/(a+b) ´ 100% (D)40a/(22a+23b) ´ 100%
( )4、保存少量金属钠的正确方法是放入
(A)水中 (B)煤油中 (C)碳酸中 (D)汽油中
( )5、钠原子与钠离子比较,相同的是
(A)核外电子层数 (B)最外层电子数
(C)化学性质 (D)同一种元素
( )6、钠应用在电光源上可制造高压钠灯是因为
(A)钠是活泼金属 (B)钠燃烧时产生黄色火焰
(C)钠发出的黄光射程远,透雾力强。(D)钠是电的良导体。
( )7、已知氢化钠(NaH)可与水反应生成氢氧化钠和氢气,有关此反应说法不正
确的是
(A)氢化钠是还原剂 (B)氢气是还原产物又是氧化产物
(C)此反应不是氧化还原反应(D)氧化剂与还原剂的量比为1:1
( )8、下列各组金属中,将它们的混合物1.5g,投入足量水中,收集到0.05g氢气,
可能是下列哪两种金属
(A)Na和 Fe (B)Rb和Cu (C)K和Na (D)Li和Na
( )9、将钠放入滴有石蕊试液的水中,下列有关现象错误的是
(A)钠浮在水面 (B)钠熔化成小球并在水面上四处游动
(C)有气体产生 (D)水溶液变为红色
( )10、金属钠分别与下列溶液反应时,既有气体又有沉淀产生的是
(A)HCl (B)NaCl (C)FeCl3 (D)CuSO4
( )11、金属钠分别在过量的O2和Cl2中燃烧,产生相同的现象是
(A)都产生黄色烟 (B)都产生白色烟
(C)都发光发热 (D)都生成白色固体
( )12、下列金属与水反应最剧烈的是
(A)锂 (B)钾 (C)铯 (D)钠
( )13、下列有关钠的化学性质的叙述,正确的是
(A)Na与H2O剧烈反应生成NaOH和H2
(B)Na在空气里燃烧生成Na2O
(C)Na投人到CuSO4溶液中可置换出Cu
(D)常温下Na与C12、S等都能剧烈反应
( )14、CO2与Na2O2的反应中,Na2O2是
(A)氧化剂 (B)还原剂
(C)既不是氧化剂也不是还原剂 (D)既是氧化剂也是还原剂
( )15、某物质的焰色反应为浅紫色,则该物质一定是
(A)钾的单质 (B)钾的化合物 (C)含有钾元素 (D)含有钾离子
( )16、下列有关碱金属的叙述不正确的是
(A)碱金属离子都有氧化性 (B)单质和水反应都能生成碱和氢气
(C)碳酸盐受热都易分解 (D)单质的熔沸点随质子数的增加而降低
( )17、下列物质露置于空气中,能发生氧化还原反应而变质的是
(A)Na (B)NaOH (C)Na2CO3 (D)NaHCO3
( )18、等质量的Na2CO3、NaHCO3与足量盐酸作用,符合下列情况的是
(A)Na2CO3比NaHCO3反应速率快
(B)相同条件下Na2CO3产生的CO2体积大
(C)NaHCO3比Na2CO3反应剧烈
(D)两者放出CO2的体积一样
( )19、为确证NaHCO3固体中是否含Na2CO3,下列实验操作及判断正确的是
(A)观察加热时能否放出气体
(B)观察加盐酸时能否放出气体
(C)溶于水中,加入澄清石灰水,观察是否有白色沉淀生成
(D)溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成
( )20、下列反应的离子方程式书写正确的是
(A)碳酸钠溶液跟盐酸混合CO32- + 2H+ == CO2↑+ H2O
(B)碳酸氢钠溶液跟石灰水混合 HCO3- + OH- = CO32-+ H2O
(C)碳酸氢钠溶液跟氢氧化钠溶液混合 H+ + OH- = H2O
(D)金属钠投入水中Na + H2O = Na+ + OH- + H2↑
( )21、下列各组离子中通常只能用焰色反应来鉴别的是
(A)Ca2+、Cu2+、Mg2+ (B)K+、Ag+、CO32-
(C)K+、Ba2+、OH- (D)Na+、Li+、Rb+
( )22、常温下,将一块金属钠露置于空气中,逐渐发生变化的过程是
![]()
![]()
![]() (A)Na Na2O2 NaOH Na2CO3
(A)Na Na2O2 NaOH Na2CO3
![]()
![]()
![]()
![]() (B)Na Na2O Na2O2 NaHCO3 Na2CO3
(B)Na Na2O Na2O2 NaHCO3 Na2CO3
![]()
![]()
![]() (C)Na Na2O NaOH
NaHCO3
(C)Na Na2O NaOH
NaHCO3
![]()
![]()
![]() (D)Na Na2O NaOH Na2CO3
(D)Na Na2O NaOH Na2CO3
( )23、将一定量的Li、Na、K投入足量水中,若在相同条件下收集到相同体积的
H2,则加人的Li、Na、K的质量比为
(A)l∶l∶1 (B)7∶23∶39 (C)1/7∶1/23∶1/39 (D)31∶11∶9
( )24、将少量金属钠放人盛有CuSO4溶液的烧杯中,剧烈反应,有蓝色沉淀及无色
气体产生。则烧杯中发生的反应是
①2Na + CuSO4 == Na2SO4 + Cu ② Cu + 2H2O == Cu(OH)2↓+ H2↑
③2Na + H2O == 2NaOH + H2↑ ④2NaOH + CuSO4 == Cu(OH)2↓+2H2O
(A)① (B)①② (C)③④ (D)①③
( )25、在稀溶液中下列离子能共存,且加人NaOH溶液有沉淀析出,加人盐酸有气
体逸出的一组是
(A)Na+、SO42-、Cu2+、Cl- (B)Na+、Ca2+、Cl-、HCO3-
(C)K+、Na+、NO3-、CO32- (D)Ca2+、K+、SO42-、CO32-
( )26、某浅黄色粉末,常用作潜水员的供氧剂。在该供氧反应中,被氧化和被还原
的物质的质量比是
(A)1∶1 (B)2∶1 (C)3∶1 (D)3∶2
( )27、碳酸钠和碳酸氢钠的混合物加热到质量不再变化时,质量减少了7.44g,以
下结论错误的是
(A)产生CO2 5.28g
(B)原混合物中含NaHCO3 20.16g
(C)原混合物中一定含Na2CO3 12.72g
(D)无法根据上述数据求出原混合物中Na2CO3的质量
( )28、某碱金属M的氧化物5.64g中含氧0.96g,则M的相对原子质量是
(A)7 (B)23 (C)39 (D)56
( )29、含有铷和另一种碱金属的合金 4.0g与H2O作用得到0.2gH2,则合金中另一
种金属可能是
(A)Li (B)Na (C)K (D)CS
( )30、一块表面已被氧化生成Na2O的金属Na,其质量为10.8g,将其投人100gH2O
中,放出H2 0.2g。则被氧化的钠的质量是
(A)4.6g (B)6.2g (C)7.8g (D)9.2g
二、填空题
31、下列化学方程式,是氧化还原反应的用双线桥标出电子转移情况,指出氧化剂和还
原剂:
(1)钠在空气中燃烧;
(2)小块钠与硫粉混合研磨;
(3)钠和水反应;
(4)碱金属(用M表示)的氧化物与水反应的化学方程式;
32、碱金属包括___________________________________等元素(填名称和元素符号),它们的最外层有______个电子,在反应中容易_______电子,因此是非常活泼的金属;由于它们的氧化物的水化物都是__________________,所以统称为____________。
33、一小块金属钠投入盛有硫酸铜溶液的烧杯中,①钠______(浮、沉)在水面______(上、下),说明______________;②此时钠呈______态,说明_____________,③发出________响声,钠 (静止不动、四处游动),说明______________________,④溶液中有__ ____产生。⑤以上反应的化学方程式为_______________________。
34、钠与水反应的离子方程式为_______________________________。
35、 用如图所示装置测定某碱金属的相对原子量,仪器本身连同水及干燥管内的无水CaCl2的总质量为480.00 g。现将1.46 g某碱金属单质投入水中,立即用带有干燥管的塞子塞住瓶口,反应完毕后,测得整套仪器的总质量为481.25 g。该金属元素的相对原子质量是_______,若不用干燥管,测得的相对原子质量比实际相对原子质量__________(大、小、相等)。
用如图所示装置测定某碱金属的相对原子量,仪器本身连同水及干燥管内的无水CaCl2的总质量为480.00 g。现将1.46 g某碱金属单质投入水中,立即用带有干燥管的塞子塞住瓶口,反应完毕后,测得整套仪器的总质量为481.25 g。该金属元素的相对原子质量是_______,若不用干燥管,测得的相对原子质量比实际相对原子质量__________(大、小、相等)。
三、计算题:
36、有一表面被氧化成氧化钠的金属样品5.22 g,投入到100 g水中,产生氢气0.2 g.
求:
(1)此样品中钠的纯度?
(2)所得溶液溶质的质量分数?
37、将70g过氧化钠和氧化钠的混合物跟98g水充分反应,所得的氢氧化钠溶液的质量分数为50%,试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混合物中过氧化钠和氧化钠的质量各为多少克?
参考答案
一、选择题
1.A 2.C 3.D 4.B 5.D 6.C 7.CD 8.AC 9.D 10.CD 11.C
12.C 13.A 14.D 15.C 16.C 17.A 18.C 19.D 20.A 21.D 22.D 23.B
24.C 25.B 26.A 27.C 28.C 29.A 30.A
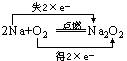 二、填空题
二、填空题
31.(1) 氧化剂:O2 还原剂:Na
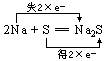 |
(2) 氧化剂:S 还原剂:Na
 |
(3) 氧化剂:H2O 还原剂:Na
(4) M2O + H2O== 2 MOH
32.锂Li 钠Na 钾K 铷Rb 铯Cs 钫Fr,1,失去,强碱,碱金属
33.①浮,上,![]() ,②液,溶点低,反应放热,
,②液,溶点低,反应放热,
③嘶嘶,四处游动,反应剧烈、放出气体;
④溶液中有碱生成,2Na+2H2O == 2NaOH+ H2↑,2NaOH+CuSO4==Na2SO4+Cu(OH)2↑
34.![]()
35.6.95,小
三、计算题
36、(1)88.1%(2)8.4%
37、Na2O2:39g Na2O:31g