邹平一中高一化学第一次月考测试题
Ⅰ卷(共54分) 2005.10
一、选择题(本题包括18小题,每题3分,共54分。每题有1-2个选项符合题意。)
1、下列科研成果不是由我国发明或创造的是( )
A、世界上第一个由人工合成的、具有生理活性的蛋白质——结晶牛胰岛素
B、黑火药和造纸 C、发现元素周期律
D、世界上首次人工合成的酵母丙氨酸转移核糖核酸
2、用自来水养金鱼时,通常先将自来水晒一段时间再注入鱼缸,目的是( )
A、提高水温 B、增加水中氧气的含量
C、除去水中少量的次氯酸 D、用紫外线杀死水中的细菌
3、0.1mol某元素的单质直接与氯气反应后,消耗Cl27.1g,这种元素是( )
A、Na B、Mg C、Fe D、Al
4、金属钠与下列物质的浓溶液反应,既有沉淀生成又有气体放出的是( )
A、Mg(NO3) B、HNO3 C、Na2SO4 D、NH4Cl
5、在标准状况下,与32gO2的体积相等的N2为( )
A、质量为14g B、分子数为6.02×1024
C、体积为22.4L D、物质的量为2mol
6、下列物质都能导电,其中属于电解质的是( )
A.NaCl溶液 B.铁丝 C.稀硫酸 D.熔融的NaOH
7.下列叙述正确的是
A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液。
B.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L。
C. 将wg a%的NaCl溶液蒸发掉![]() g水,得到2a%的NaCl溶液。
g水,得到2a%的NaCl溶液。
D. 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L
8、下列物质属于纯净物的是
A、稀硫酸 B、NaOH
C、NaOH溶液 D、天然气
9.有一瓶14%的KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL,这80mL溶液的物质的量浓度为 ( )
A.5mol/L B.6mol/L C.6.25mol/L D.6.75mol/L
10.某溶液中含有较大量的Cl-、CO32-、OH- 等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是 ( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
11.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是( )
A、Al3+ CH3COO- Cl- B、Mg2+ Ba2+ Br-
C、Mg2+ Cl- CO32- D、Na+ NH4+ Cl-
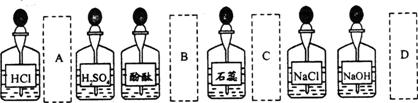
12、实验室中的药品常按物质的性质、类别等有规律地放置。做“酸的性质”实验时,实验桌上部分药品的摆放如下图。某同学取用KOH溶液后,应把它放回的位置是( )
13.能正确表示下列化学反应的离子方程式的是
A.澄清的石灰水与盐酸的反应 OH-+H+ = H2O
B.氧化铜与硝酸(aq)反应 O2- + 2H+ = H2O
C.硫酸镁(aq)与氢氧化钡(aq)混合 Ba2++SO42-=BaSO4↓
D.碳酸钠溶液中加入稀盐酸 CO32-+H+=H2O+CO2
14.下列分离或提纯物质的方法正确的是 ( )
A.用渗析的方法精制Fe(OH)3胶体
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
15.用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A、100mL 0.1mol·L-1的稀硫酸中含有SO42-个数为0.1NA
B、常温常压下,4g氦气所含有的中子数为4NA
C、2.7g金属铝与足量的盐酸反应,铝失去电子数为3NA
D、12.4g白磷(分子式为P4)中含有磷原子数为0.4NA
16.下列各组气体或溶液用括号内试剂加以鉴别,其中合理的是 ( )
A.二氧化碳、一氧化碳、甲烷(新制的澄清石灰水)
B.氧气、氢气、氮气(炽热的氧化铜粉末)
C.氯化钠、硝酸银、碳酸钠(稀盐酸)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
17.下列反应中氯元素被氧化的是( )
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.Na2CO3 + 2HCl = 2NaCl +CO2↑+H2O
C.MnO2+4HCl=MnCl2+2H2O+Cl2↑
D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
18、吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是 ( )
A、作还原剂 B、作氧化剂
C、既作氧化剂又作还原剂 D、既不作氧化剂又不作还原剂
考号__________________班级_________ 姓名____________得分____________
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
Ⅱ卷(共46分)
二、填空题
19、(11分)某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制成500mL 0.5mol/L的稀H2SO4
(1)填写下列操作步骤:
①所需浓H2SO4的体积为
②如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒量取。
③将量取的浓H2SO4沿玻璃棒慢慢注入盛有约100mL水的 里,并不断搅拌,目的是 。
④立即将上述溶液沿玻璃棒注入 中,并用50mL蒸馏水洗涤烧杯2~3次,并将洗涤液注入其中,并不时轻轻振荡。
⑤加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平。盖上瓶塞,上下颠倒数次,摇匀。
(2)请指出上述操作中一处明显错误: 。
(3)误差分析:(填偏高、偏低、无影响)
操作②中量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 ;
若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将 ;
操作⑤中,若定容时,眼睛俯视,则所配制的溶液浓度将 。
20、(4分)17克NH3共有_____________mol原子,0.1molH2S共有___________个氢原子;同温同压下,同体积的NH3和H2S气体的质量比为__________________;同质量的NH3和H2S中分子个数比为_______________。
21、(12分)现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D的分子式分别为:
A__________ B_________ C___________ D_________。
(2)写出下列各反应的化学方程式:
A与B_______________________________________________
B与水_______________________________________________
B与NaOH溶液______________________________________
C与澄清石灰水_______________________________________
22、(8分)写出下列反应的离子方程式:
(1)MgSO4(aq)与Ba(OH)2(aq)反应
(2)Fe(OH)3溶于稀硫酸
(3)CO2通入澄清的石灰水
(4)K2CO3(aq)与AgNO3(aq)反应
23、(2分)鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色Fe3+。这个变色的过程中的Fe2+被 __________(填“氧化”或“还原”)。若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有: 。
A、氧化性 B、还原性 C、酸性 D、碱性
三、计算题
24、(9分)将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)6.50g锌的物质的量
(2)所用盐酸中HCl中的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
邹平一中高一化学第一次月考测试题参考答案
一、
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| C | C | B | A | C | D | CD | B | C | B | D | D | A | A | D | CD | CD | A |
二、19、(1)13.6mL;
20;
烧杯;
混合均匀,使热量迅速扩散;(或其它合理答案也得分)
500mL容量瓶(未写500mL不得分);
1~2cm;
胶头滴管
(2)④处,溶液未冷却至室温就转移至容量瓶中
(3)偏低、无影响、偏高
21、4 ; 1.024×1023 ; 1:2 ; 2:1
22、(1)H2 Cl2 CO2 HCl (4分)
(2)H2+Cl2====2HCl(每式2分)
Cl2+H2O====HCl+HClO
Cl2+2NaOH====NaCl+ NaClO+H2O
CO2+Ca(OH)2====CaCO3↓+H2O
23、氧化 ; B
三、24、(1)0.10mol
(2)1.00mol/L
(3)2.24L