2005-2006学年度下学期
高中学生学科素质训练
高一化学同步测试(5)—二氧化硫
说明:本试卷分第一卷和第二卷两部分,第一卷48分,第二卷52分,共100分;答题时间90分钟.
第I卷(共48分)
一、选择题(共6小题,每小题3分,共18分。只有1个正确答案)
1.酸雨有很大的危害。下列气体在空气中达到一定含量时,可形成酸雨的是 ( )
A.NH3 B.CO C.SO2 D.H2
2.实验室制备SO2气体,下列方法可行的是 ( )
A.Na2SO3溶液与HNO3 B.Na2SO3溶液与稀盐酸
C.Na2SO3与H2S溶液 D.Na2SO3固体与浓H2SO4
3.下列物质长久放置后,因被空气氧化而变质的是 ( )
A.NaOH溶液 B.Na2SO3溶液 C.澄清石灰水 D.氯
4.关于SO2和SO3的说法错误的是:①都是酸酐,②与水化合都能生成相应的酸,③都能与碱反应生成正盐或酸式盐,④通常条件下都是气体,⑤都有还原性 ( )
A.①④ B.④⑤ C.③⑤ D.②③
5.物质的量相同浓度相同、体积相同的下列溶液中,吸收SO2 气体的量最多的是( )
A.氨水 B.碳酸钠 C.硫化钠 D.氢氧化钡
6.某无色气体,可以使湿润的蓝色石蕊试纸变红,通入澄清石灰水中,石灰水变浑浊,接着又变澄清,将燃着的蜡烛放入盛有该气体的集气瓶中蜡烛熄灭,则该气体 ( )
A.一定是CO2 B.一定是SO2
C.可能是CO2或SO2 D.一定是CO2和SO2混和气体
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一至二个选项符合题意,少选扣1分,多选、错选均不给分)
7.下列各组气体在常温、常压下能共存且能用浓硫酸干燥的是 ( )
A.SO2、O2、H2S B.H2、O2、F2
C.O2、C12、HCI D.H2S、CO2、H2
8.下列溶液中,不能区别SO2和CO2气体的是 ( )
①石灰水;②H2S溶液;③KMnO4溶液;④溴水;⑤酸化的Ba(NO3)2溶液;⑥品红溶液
A.①②③⑤ B.②③④⑤ C.只有① D.①③
9.下列说法错误的是 ( )
A.Na2SO3与BaCl2溶液作用,有白色沉淀,加稀硝酸后沉淀不消失
B.将SO2气体通入Ba(OH)2溶液中有白色沉淀生成
C.将SO2气体通过BaCl2溶液中有白色沉淀生成
D.将SO2气体通入用硝酸酸化的BaCl2溶液中有白色沉淀生成
10.SO2既有氧化性,又有还原性,主要表现为还原性。下列反应中,SO2表现为还原性的反应是 ( )
A.SO2十2H2S=3S¯+2H2O B.SO2十NO2![]() SO3十NO
SO3十NO
C.SO2十2KOH=K2SO3+H2O D.SO2十2H2O+C12=H2SO4+2HCI
11.实验室所需某些溶液中,宜随用随配、不宜长久存放的是 ( )
① 稀盐酸 ② 氯水 ③ 亚硫酸 ④ 氢硫酸
A.只有①② B.只有②③④ C.只有②④ D.①②③④
12.CO2中含有少量水蒸气、HC1、H2S和O2。现用①NaHCO3溶液、②浓H2SO4、③灼热铜网、④CuSO4溶液来分别除去这四种杂质气体。四个选项是混合气体通过的顺序,其中合理的是 ( )
A.①④②③ B.④②③① C.④③②① D.①②③④
13.下列物质间发生反应时,都有SO2生成的是:① 硫在空气中燃烧 ② 含硫的化合物在空气中灼烧 ③ 亚硫酸钠和硫酸反应 ④ 硫化氢在空气中完全燃烧 ⑤ 铜和热浓硫酸反应 ( )
A.只有①③④ B.只有①⑤ C.只有①③④⑤ D.①②③④⑤
14.在200mL 0.2mol·L-1NaOH溶液中通入一定量SO3气体,在一定条件下蒸发所得溶液,
析出的固体物质只有4.8g,该固体物质的成分可能是 ( )
A.Na2SO4 B.NaHSO4 C.Na2SO4·10H2O D.NaHSO4·10H2O
15.硝酸是强氧化性酸,它能使许多物质被氧化。例如(® 所指为氧化产物):
S2- ® S ® SO42- SO32- ® SO42- I- ® I2 ® HIO3
由此可知,下列用硝酸制取气体的反应中能采用的只有 ( )
A.用硝酸和硫化亚铁反应制H2S B.用硝酸和石灰石反应制CO2
C.用碘化钠和硝酸反应制HI D.用亚硫酸钠和硝酸反应制SO2
16.将x mo1 Na2SO3和y mo1 Na2S完全溶于水后,再加入稀H2SO4酸化,其产物可能有三
种情况:① 生成物只有S、Na2SO4和水;② 生成物为SO2、S、Na2SO4和水;③ 生成
物为H2S、S、Na2SO4和水。则x∶y的值也应有三种情况:a(大于0.5),b(小于0.5),c(等于0.5),按上述①、②、③顺序选出x∶y的比值排列正确的是 ( )
A.c、a、b B. a、b、c C. a、c、b D.c、b 、a
第Ⅱ卷(共52分)
三、填空题(共6小题,计44分)
17.(4分)下列溶液中通入SO2时都会褪色,但二氧化硫的作用却可能不同。请分别再横线上写出在各变化中所体现的二氧化硫的性质:
SO2通入酸性高锰酸钾溶液中红色褪去。______ ;SO2通入品红溶液红色褪去。________ ;SO2通入溴水溶液中红棕色褪去。_______ ;SO2通入氢氧化钠与酚酞的混合溶液红色褪去。_______ 。
18. (4分)将SO2通入溴水中,溴水褪色,是否是SO2的漂白性?________,其实质是________
__ 。将SO2通入红色的酚酞溶液中,溶液褪色,是否是SO2的漂白性?_____,其实质是____________________________________________。
19.(8分)(1)为降低硫的氧化物对空气的污染,可把氧化钙和含硫的煤混和后燃烧,这种方法叫做钙基固硫,试写出有关的化学方程式 _________________、________________.
(2)火力发电站废气中含有SO2。为除去有害气体SO2,可用碳酸钙或氢氧化钙的悬浊
洗涤,反应产物为CaSO4,写出上述两种途径有关的化学方程式。
①
②
试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由_________________
______________________________________________________________________。
20.(10分)某中学一研究性学习小组在研究亚硫酸盐的性质时遇到了如下情况:在坩埚中充分加热Na2SO3•7H2O时,发现所剩固体的质量与“预期值”惊人吻合,但其水溶液的酸碱性却与“预期值” 相去甚远,呈很强的碱性。该小组对这一问题进行了探究,他们的研究流程大致如下图所示。回答下列问题:
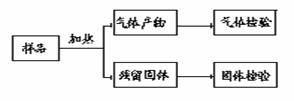 |
(1)请你为他们的研究拟定一个标题 。
(2)该小组的研究方法是 。
(3)检验气体产物中有SO2的试剂是 。
(4)检验固体产物有较强碱性的方法是 。
(5)写出上述过程中Na2SO3•7H2O受热变化的化学方程式 。21.(4分)向20mL0.2 mol·L-1的NaOH溶液中缓缓通入V LSO2气体,在一定条件下蒸
干,得到的固体是纯净物.则通入SO2的体积是________L(标准状况下的体积),反应的离子方程式是________ 。
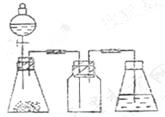
22.(14分)研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
 |
②实验过程中,使用分液漏斗滴加浓硫酸的操作是___________________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是_____________________________________________;
②溴水溶液,现象是_____________________________________________;
③硫化钠溶液,现象是___________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因_____________________;验证方法__________________________。
②原因_____________________;验证方法__________________________。
③原因_____________________;验证方法__________________________。
四、计算题(8分)
23.(8分)某工厂排出的废水里含0.012 mol / L的游离态溴和0.002 mo1·L-1的氢离子,加入还原剂Na2SO3可除去废求中的溴。试回答。
(1)写出Na2SO3和Br2反应的化学方程式。
(2)每处理l m3的该废水,需加入0.05 mol·L-1的Na2SO3溶液多少升?
(3) 除去溴后的溴水中氢离子的物质的量浓度约为多少?(提示:HBr的物质的量浓度=电离出的H+的物质的量浓度)
参考答案
一、选择题
1.C 2.D 3.B 4.B 5.C 6.C
二、选择题
7.C 8.C 9.C 10.BD 11.B 12.A 13.D 14.B 15.B 16.A
三、填空题
17.(1)还原性;(2)漂白性;(3)还原性;(4)酸酐的性质。
18.不是,因为SO2
+ Br2 + 2H2O ![]() H2SO4 + 2HBr
H2SO4 + 2HBr
不是;因为SO2 + 2OH-![]() SO32- + H2O
SO32- + H2O
19.(1)S+O2 = SO2 ,2CaO+2SO2+O2 == 2CaSO4(或:SO2+CaO=CaSO3;2CaSO3+O2=2CaSO4)
(2)①2SO2+2CaCO3+O2+4H2O==2CaSO4·2H2O+2CO2
②2SO2+2Ca(OH)2+O2+2H2O==2CaSO4·2H2O
因为石灰乳中Ca(OH)2的含量较多,吸收SO2的容量较大
20.(1)Na2SO3•7H2O受热探讨;(其他合理答案均可计分)
例如:加热Na2SO3•7H2O的研究;加热Na2SO3•7H2O的实验。
(2)实验法。(3)品红(其他合理答案均可计分) (4)指示剂法或pH试纸
(5)62Na2SO3•7H2O
+ 23O2![]() 32NaOH + 418H2O + 46Na2SO4
+ 16SO2
32NaOH + 418H2O + 46Na2SO4
+ 16SO2
 21.0.0448L SO2+2OH-
21.0.0448L SO2+2OH-![]() SO32-+H2O 或0.0896L
SO2+OH-
SO32-+H2O 或0.0896L
SO2+OH-![]() HSO3-+H2O
HSO3-+H2O
22.(1)①如图配置
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,
缓慢滴加。
(2) ①溶液褪色 ②溶液褪色 ③有浅黄色沉淀
(或溶液变浑浊)
(3)①NaSO3 变质
取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2 ,溶液有白色沉淀生成,则证明该NaSO3 固体变质
②不是浓硫酸
用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
四、计算题
23.(1)Na2SO3+Br2+H2O=Na2SO4+2HBr (2)n( Br2)=103 L×0.012 mol / L=12 mol
n( Na2SO3 )=n( Br2)=12 mol V( Na2SO3 )=![]() =240 L
=240 L
(3) 原溶液中n(H+)=103 L×0.002 mol / L=2 mol c(H+)=![]() =0.021 mol / L
=0.021 mol / L