淮安中学2005/2006学年高一化学必修1第一单元测试题
可能用到的相对原子质量:H-1,C-12,N-14,O-16,Na-23,Mg-24,Al-27,P-31,S-16,Cl-35.5, Ar-40,K-39
一、选择题 (本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.以下是一些常用的危险品标志,装运乙醇(酒精)的包装箱应贴的图标是
 | |||||||
 |  | ||||||
 | |||||||
A. B. C. D.
2.下列实验操作中正确的是
A.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
B.Ba(NO3)2 溶于水,可将含Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道
C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
3.如果你家里的食用花生油混有水份,你将采用下列何种方法分离
A.过滤 B.蒸馏 C.分液 D.萃取
4.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.cba
5.二硫化碳(CS2,标况下为液体)能够在氧气中完全燃烧生成CO2和SO2,今用0.228g CS2在448mL O2(在标准状况下)中完全燃烧,反应后气体混合物在标准状况下的体积是
A.112mL B.224mL C.336mL D.448mL
6.下列名词中,哪个名词不属于物理量
A. 长度 B. 质量 C. 摩尔 D. 时间
7.科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是
A.原子数 B.分子数 C.体积 D.物质的量
8.实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是
A.1000mL,212g B.950mL,543.4g C.任意规格,572g D.500mL,286g
二、选择题 (本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
9.将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为
A.50mL B.50.5mL C.55mL D.59.5mL
10.一组失去标签的溶液,不另加其他试剂(仅利用组内物质间反应)就能区别开来,这组溶液是
A.FeCl3、NaOH、KCl、Ba(NO3)2 B.NaCl、Na2CO3、KNO3、HCl
C.BaCl2、CuSO4、NaOH、NaCl
D.Na2SO4、BaCl2、K2CO3、KNO3
11.用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.100mL 0.1mol·L-1的稀硫酸中含有SO42—个数为0.1NA
B.1molCH3+(碳正离子)中含有电子数为10NA
C.2.7g金属铝与足量的盐酸反应,铝失去电子数为3NA
D.12.4g白磷(分子式为P4)中含有磷原子数为0.4NA
12.下列两种气体的分子数一定相等的是
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温等体积的O2和N2 D.等压等体积的N2和CO2
13.在0℃和101 kPa的条件下,将4.00 g 氩气、1.40 g 氮气和1.60 g 氧气混合,该混合气体的体积是的密度是相同条件下氢气密度的
A.35倍 B.17.5倍 C.7倍 D.14倍
14.水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等。下列方法中也可以用来进行海水淡化的是
A.过滤法 B.蒸馏法 C.分液法 D.冰冻法
15.在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为
A.1:2:3 B.3:2:1 C.1:1:1 D.6:3:2
16.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
① 滴加Mg(NO3)2溶液;② 过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
淮安中学2005/2006学年高一化学必修1第一单元测试题
班级 姓名 学号 成绩
选择题答案(共56分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
三、填空题(共35分)
17. (12分) 实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1) 配制250mL0.1mol/L的盐酸溶液
| 应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _ _____;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为_________ _________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
18. (15分)氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称
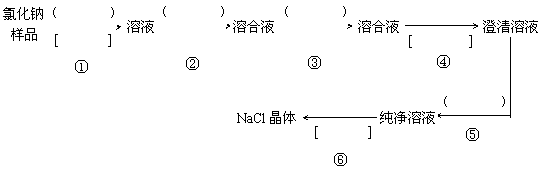
写出有关反应的化学方程式:
第步②
第步③
第步⑤
19.(3分)4.5g水与 g硫酸所含的分子数相等,它们所含氧原子数之比是 ,其中氢原子数之比是 。
20.(5分)200 mL 2.00 mol/L的Al2(SO4)3溶液中含有 mol Al2(SO4)3,Al3+的物质的量浓度为 ,SO42-的物质的量浓度为 ,含Al3+的物质的量为 ,质量为 。
四、计算题(共9分)
21.取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
求(1)稀盐酸物质的量浓度(2)Na2CO3·xH2O的摩尔质量(3)x值
淮安中学2005/2006学年高一化学必修1第一单元测试题参考答案及评分标准
1、D 2、A 3、C 4、C 5、D 6、C 7、A 8、A
9、B 10、C 11、D 12、AB 13、B 14、BD 15、D 16、B
17.(1)2.1,250,量筒、烧杯、玻璃棒、胶头滴管。(2)B、C、A、F、E、D
(3)保证溶质全部转入容量瓶。容量瓶盛放热溶液时,体积不准,也易导至容量瓶炸裂。(4)浓度偏低;偏低;偏高。(5)宣告实验失败,洗净容量瓶后重新配制;宣告实验失败,洗净容量瓶后重新配制。
18.① 蒸馏水;溶解 ② BaCl2溶液 ③ Na2CO3溶液 ④ 过滤 ⑤ 稀盐酸
⑥ 蒸发结晶(每空1分,共7分)
② Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl ,Na2CO3 + BaCl2 = BaCO3↓+2NaCl
③ BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl
⑤ Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(每一式2分,共8分)
19. 24.5 , 1:4 , 1:1
20.0.400mol;4.00mol/L;6.00mol/L;0.800mol;21.6g 5分(未注意有效数字者本题总共扣1分)
21. (1)5.0mol/l (2)286g/mol (3)10(各3分,共9分)