高一化学必修2第一章单元检测
可能用到的相对原子质量: H:1 C:12 N:14 O:16 S:32 Cl:35.5 Na:23
一、选择题(包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.据中央电视台11月15日焦点访谈报道今年6月中旬,在黑龙江省哈尔滨市的一个居民小区,同住一栋楼的两家人相继得上一种怪病:红细胞、白细胞、血小板严重偏低。经黑龙江省辐射监督管理站的专家检测,发现是放射性物质铱—192在作怪。则19277Ir中的中子数和质子数之差为( )
A.115 B.38 C. 269 D.154
2.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前 10号元素中,满足上述关系的元素共有 ( )
A. 1对 B.2对 C. 3对 D. 4对
3.下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.BF3 B.H2O C.SiCl4 D.PCl5
4.下列分子含有的电子数目与HF相同,且只有两个极性共价键的是( )
A.CO2 H2O C.N2O D.CH4
5.下列电子式,正确的是( )
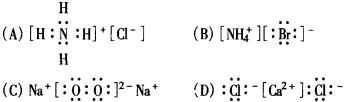
6.下列物质中属于共价化合物的是( )
A.Na2O2 B.I2 C.NaHSO4 D.HNO3
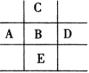 7. 图为周期表的一部分,已知A,B,C,D,E五种元素原子核外共有85个电子,E原子核外有四个电子层,B元素是( )
7. 图为周期表的一部分,已知A,B,C,D,E五种元素原子核外共有85个电子,E原子核外有四个电子层,B元素是( )
(A)P (B)Mg (C)Cl (D)Si
8. 随着卤素原子半径的增大,下列递变规律正确的是 ( )
A.单质熔、沸点逐渐降低 B.气态氢化物稳定性逐渐增强
C.卤素离子的还原性逐渐增强 D.单质的氧化性逐渐增强
9.第4周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是 ( )
A.原子半径比钾的原子半径大 B.氯化物难溶于水
C.其氢氧化物的碱性比NaOH强 D.碳酸盐难溶于水
10.无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。按此规定,下列说法中错误的是 ( )
A.第15列元素的最高价氧化物的化学式是R2O3
B.第1列和第17列元素单质熔、沸点变化趋势相反
C.第11列中肯定没有非金属元素
D.在18列元素中,第3列的元素种类最多
二.选择题(包括10小题,每小题3分,共30分。每小题只有一个或两个选项符合题意。)
11.下列化合物的电子式书写正确的是( )
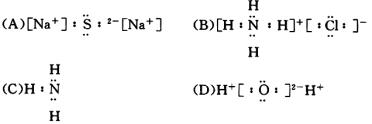
12.某元素最高正价与负价绝对值之差为4,该元素的离子跟与其核外电子排布相同的离子形成的化合物是( )
A.K2S B.MgS C.MgO D.NaF
13.医疗上常用含131I—的药物进行甲状腺疾病的诊断。已知碘元素的核电荷数为53,下列关于131I—的说法正确的是 ( )
A. 131I—的质量数是132 B. 131I—的核外有54个电子
C. 131I—的核内有53个中子 D. 131I—的核内有74个质子
14.下列物质中,既有离子键,又有共价键的是( )
(A)CaCl2 (B)KOH (C)H2O (D)NH4F
15.最近,科学家研制是一种新的分子,它具有类似足球状结构,化学式为 ![]() ,下列说法正确的是( )
,下列说法正确的是( )
(A) ![]() 是一种新型化合物 (B)
是一种新型化合物 (B) ![]() 和金刚石都是碳的单质
和金刚石都是碳的单质
(C) ![]() 含离子键 (D)
含离子键 (D) ![]() 中含共价键
中含共价键
16.下列说法中不正确的是( )
A.在共价化合物中也可能含有离子键 B.非金属之间形成的化学键一定是共价键
C.含有共价键的化合物不一定是共价化合物 D.含有离子键的化合物一定是离子化合物
17.下列各组大小顺序不正确的是 ( )
A.粒子半径:S2- > Cl-> Na+ > Mg2+ B.热稳定性:SiH4 < PH4 < H2S < HCl
C.熔点:SiO2 > NaCl > 干冰 > 碘 D.还原性:HF < HCl < HBr < HI
18.已知X、Y、Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是
HZO4>H2YO4> H3YO4 ,下列判断正确的是 ( )
A.3种元素阴离子还原性按X、Y、Z的顺序增强
B.单质的氧化性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.原子半径按X、Y、Z的顺序减小
19.下列有关碱金属铷(Rb)的叙述中,正确的是 ( )
A.灼烧氯化铷时,火焰有特殊颜色 B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是弱碱
20.第七周期为不完全周期,若将来的发展把这一周期元素全部排满。则下列关于第七周期元素的推论可能错误的是 ( )
A.第七周期排满时有32种元素
B.第七周期排满时最后一种单质不与任何物质发生化学反应
C.第七周期第ⅦA族元素原子序数117,是一种金属元素
D.第七周期第ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质
三、填空题(共28分)
1.(8分)写出下列微粒的符号及结构示意图
①原子核内有10个质子的原子________
②核外有10个电子的二价阳离子________
③核外有18个电子的一价阴离子________
④L为最外层,L层电子数是K层电子数的3倍的原子________
2.(10分)A、B、C、D、E为元素周期表中前三周期的主族元素,它们的原子序数按A、B、C、D、E的顺序增大。A的最外层电子数是次外层电子数的2倍,C与E最外层电子数相等,E的最高价氧化物中含氧60%,D与C可形成 ![]() 、
、
![]() 两种离子化合物。填写下列空白:
两种离子化合物。填写下列空白:
(1)写出上述五种元素的元素符号:A_____,B_____,C_____,D_____,E_____。
(2)写出 ![]() 的电子式______________。
的电子式______________。
(3)用电子式表示 ![]() 化合物的形成过程_______________________________________
化合物的形成过程_______________________________________
四、推断题
1.(14分)有A、B、C、D、E五种元素,元素A的一种原子无中子,元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2,元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ar的电子层结构相同,试回答:
(1)它们的元素符号是:A________B________C________D________E________。
(2)A与B形成的化合物以________键结合, C和E的化合物以________键结合。
(3)A和D的化合物与C和D的化合物(DC2)能否反应?若能反应写出反应方程式。
2.(18分)已知A、B、C、D 4种元素,都是位于元素周期表中第一、二周期的元素,原子序数按A、C、D、B的顺序递增,A与C最外层电子数相同且都是1,B与C具有相同的电子层数,它们的最外层电子数相差6个.D元素最外层电子数是次外层电子数的3倍,试回答:
(1)A、B、C、D的元素名称,原子的电子式,元素在周期表中的位置.
(2)A与B、C与D、A与D都以何种化学键结合?形成什么型的化合物?分别写出它们的电子式.
班别 姓名 学号 成绩
选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
三、填空题
1.①
②
③
④
2.(1)A_____ ,B_____ ,C_____ ,D_____ ,E_____ 。
![]() (2)
(2)
(3)
四、推断题
1. (1)A________B________C________D________E________。
(2)________;________
![]() (3)
(3)
2.(1)
(2)
第一章试题参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | C | B | C | D | A | C | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | AC | B | BD | BD | AB | C | CD | AB | BD |
三、填空题
1.
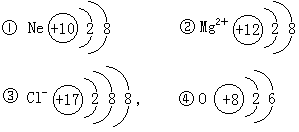
2. (1)A:C B:N C:O D:Na E:S
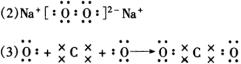
四、推断题
1.(1)A:H B:C C:O D:S E:K (2)非极性键(或共价键),离子键
(3)能。2H2S + SO2 === 2H2O + 3S¯
2.(1)A:氢, B:氟, C:锂, D:氧
(2)A-B共价键、共价化合物 ![]()
C-D离子键、离子化合物 ![]()
A-D共价键、共价化合物 ![]()