许昌市2005~2006学年高一下学期期末教学质量评估考试试卷
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟
可能用到的原子量:H:1 C:1 2 O:16 Na:23 S:32 Cl:35.5 Cu:64
Ba:137
第Ⅰ卷(选择题,共15小题,每小题3分,共45分)
一、选择题(本小题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.二氧化硫是污染大气并形成酸雨的主要有害物质之一。造成大气中二氧化硫含量急剧增加的最主要原因是( )
A.硫酸厂排放出的废气中的二氧化硫
B.由火山爆发产生的二氧化硫
C由实验室逸出的二氧化硫
D.由煤和石油燃烧产生的二氧化硫
2.下列说法中,不符合Ⅶ族元素性质特征的是( )
A.从上到下原子半径逐渐减小
B.易形成-1价的离子
C.最高价氧化物的水化物显酸性
D.从上到下氢化物的稳定性依次减弱
3.下列关于Cl2和SO2两种气体的说法中正确的是( )
A.Cl2和SO2都是强氧化剂
B.Cl2和SO2与水反应都形成稳定的酸
C.在通常情况下,SO2比Cl2易溶于水
D.Cl2和SO2的漂白原理相同。
4.设NA表示阿伏加德罗常数值,下列叙述中正确的是( )
A.在铜与硫的反应中,1mol失去的电子数为NA
B.标准状况下,11.2LSO3所含硫原子数为0.5NA
C.由![]() 所组成的水11g,其中所含的中子数为4NA
所组成的水11g,其中所含的中子数为4NA
D.1molCl2与足量的水反应,转移的电子数为2NA
5.在下列直接转化过程中,钠元素发生还原反应的是( )
A.![]() B。
B。![]()
C.![]() D。
D。![]()
6.某微粒用![]() 表示,下列关于该微粒的叙述中正确的是( )
表示,下列关于该微粒的叙述中正确的是( )
A.所含质子数=A-n B.所含中子数=A-Z
C.所含电子数=Z+n D.质量数=Z+A
7.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是( )
A.中子数 B。最外层电子数 C。电子层数 D。次外层电子数
8.在下列物质中,长期放置在空气中会因为发生氧化还原反应而变质的是( )
A.NaOH B.Na2SO4 C.Na2SO3 D. H2SO4
9.向浓盐酸中加入浓硫酸会有白雾产生,下列叙述不属于导致产生这种现象的原因是( )
A.浓硫酸具有脱水性 B。浓硫酸具有吸水性
C.盐酸具有挥发性 D。气态物质的溶解度随温度的升高而降低
10.关于硅的下列叙述中,不正确的是( )
A.在自然界中硅只以化合态形式存在。
B.硅的氧化物不能与水反应,所以它不是酸性氧化物
C.常温下,硅可以与氟气、强碱溶液起反应
D.在加热条件下,硅可与氧气、氯气、硝酸等物质反应
11.可以肯定溶液中大量存在![]() 的理由是( )
的理由是( )
A.加入AgNO3溶液有白色沉淀生成
B.加入酸有无色无味气体产生
C.加入MgCl2溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体。
D.加入Ba(OH)2溶液有白色沉淀产生,再加稀盐酸沉淀溶解。
12.a.b.c.d.e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b a e d c B. e d a b c
C. a b d c e D. c d e a b
13.短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
| X | ||
| Y | ||
| Z |
A.Z一定是活泼的金属
B.Y的最高价氧化物的水化物是一种强酸
C.Z的最高价氧化物的水化物是强酸
D.1molZ单质在足量的氧气中燃烧时,有6mol电子发生转移
14.下列离子方程式书写正确的是( )
A.把铜片放入浓硫酸中并加热
![]()
B.碳酸钙与盐酸反应
![]()
C.碳酸氢钠溶液和过量盐酸混合
![]()
D.硫酸铜溶液与氢氧化钡溶液反应
![]()
15.将3.75g硫酸铜晶体(CuSO4.5H2O)加热至100°C以上,剩下粉末为2.67g,这粉末物质的化学式为( )
A.![]() B。
B。![]() C。
C。![]() D。
D。![]()
第Ⅱ卷(非选择题,共7个小题,共55分)
二、(本题包括4小题,共23分)
16.(5分)请用元素符号(或化学式)回答原子序数11~18的元素的有关问题:
(1)除稀有气体外,原子半径最大的是_________________
(2)最高价氧化物的水化物中碱性最强的是_____________
(3)最高价氧化物的水化物中呈两性的是_______________
(4) 最高价氧化物的水化物中酸性最强的是______________
(5)能形成气态氢化物中最稳定的是_________________
17.(3分)在下列物质中:①碘单质②烧碱晶体③NaCl晶体④干冰⑤固态氯化氢⑥Na2O2晶体。用序号填写下列空白:
(1)既含有离子键又含有非极性键的化合物是________________
(2)仅含有离子键的化合物是_______________________
(3) 仅含有共价键的单质是______________________
18.(9分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A的单质和它的一种氧化物是工业生产上常用的还原剂。B的最外层电子数是次外层的3倍;0.1molC的单质能从酸溶液中置换出2.24L标准状况下的氢气;又知B、C、D所形成的简单离子的电子层结构相同,B和E是同周期的元素。请回答下列问题:
(1)请依次写出A、C、E三种元素的元素符号:______、______、_______。
(2)请写出A的最高价氧化物的电子式_____________;E的单质在空气中燃烧所生成物质的化学式_________
(3)请写出D的最高价氧化物与氢氧化钠溶液反应的离子方程式
________________________________________
(4)请写出A的单质在工业生产上作还原剂时的一个化学方程式
_____________________________________________
19.(6分)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质――碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应式为:
![]()
① 此反应的氧化剂是_____________,氧化产物是____________;
②
![]() 在上述反应中表现出来的性质是_________(填选项序号)
在上述反应中表现出来的性质是_________(填选项序号)
A.酸性 B。氧化性 C。吸水性 D。脱水性
由此可知上述反应所用硫酸应为__________(填“浓”或“稀”)硫酸。
请写出碳单质与硫酸反应时的化学方程式:_____________________________________。
三、(本小包括2小题,共22分)
20.(10分)(1)请针对CO2和SO2的相同点与不同点回答问题。①它们中可以使澄清石灰水变浑浊的是_____________. ②它们中可以用向上排空气法收集的是_________. ③它们中能使品红溶液及高锰酸钾溶液褪色的是___________________。
(2)现有两位同学设计了下述两个方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证无色混合气体中含有CO2和SO2。
方案甲:气体通过酸性高锰酸钾溶液时溶液褪色,继续通过澄清石灰水时石灰水变浑浊。
方案乙:气体通过品红溶液时溶液红色变浅,继续通过澄清石灰水时石灰水变浑浊。
试评价上述各方案是否严密。若你认为哪个方案不严密,请简要说明理由:
_______________________________________________________________________________________________________________
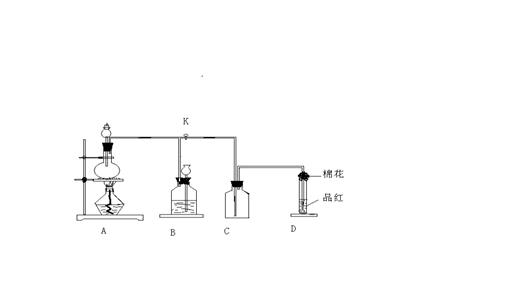
21.(12分)下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
(1)检验此装置A、B部分气密性的操作方法和现象是:________________________-
_________________________________________________________________.
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:
_______________________________________________________.
(3)装置D中试管口放置的棉花中应浸有一种液体,这液体是_____________,其作用是:______________________________________。
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)_________________;
a.水 b.浓溴水 C。KMnO4酸性溶液 D。NaHSO3饱和溶液
四、(本小题 包括1个小题,共10分)
22.(10分)。将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀盐酸,充分反应后剩余沉淀2.33g。计算:
(1)原混合物中Na2CO3的质量分数
(2)BaCl2溶液的物质的量浓度
高一化学参考答案及评分标准
一、选择题(45分)
1D 2A 3C 4A 5C 6B 7D 8C 9A 10B 11C 12A 13C 14C 15B
二、(每个方程式2分,其余每空1分,共23分)
16.(1)Na (2)NaOH (3)Al(OH)3 (4)HClO4 (5)HCl
17.(1)6 (2)3 (3)1
18.(1)C Mg S (2):![]() :C::
:C::![]() :
SO2
:
SO2
(3)![]()
(4)(写出C高温下与Si、Cu、Fe等的氧化物反应的方程式均可)
19.1K2Cr2O7 CO2
2A 稀 ![]()
三、(共22分)
20.(10分)(1) 1CO2 SO2 2CO2 SO2 3SO2 (每空2 分)
(2)方案甲不严密,(1分)因为当只有较大量的SO2时,也会出现其中的现象。(2分)。方案乙严密。(1分)
21.(12分)(1)关闭分液漏斗的活塞及K处的活塞,用酒精灯微热烧瓶,若长颈漏斗中的液面上升,说明A、B两处的气密性良好。(3分)
(2)![]() (3分)
(3分)
(3)氢氧化钠溶液 防止二氧化硫逸出。 (各2分)
(4)d (2分)
22.(10分)解:设混合物中硫酸钠的质量为x
Na2SO4-----------------------BaSO4
142 233
X 2.33g (2分)
列比例解得X=1.42g (2分)
故混合物中碳酸钠的质量为1.95g-1.42g=0.53g
碳酸钠的质量分数为0.53g/1.95g![]() 100%=27.2% (2分)
100%=27.2% (2分)
![]() Na2SO4-――――――-BaCl2 Na2CO3---------
BaCl2
Na2SO4-――――――-BaCl2 Na2CO3---------
BaCl2
![]() BaCl2的物质的量为1.42/142+0.53/106=0.015mol (2分)
BaCl2的物质的量为1.42/142+0.53/106=0.015mol (2分)
![]() BaCl2的物质的量浓度为:0.015/0.01=1.5mol/L (2分)
BaCl2的物质的量浓度为:0.015/0.01=1.5mol/L (2分)