高一(下)期末化学试题
可能用到的相对原子质量:O-16 Si-28 S-32 Cl-35.5 K-39 Cu-64 Zn-65 I-127
一、选择题(本题包括20小题,共40分。每小题只有一个选项符合题意)
1.现有以下几种措施:① 对燃烧煤时产生的尾气进行除硫处理,② 少用原煤做燃料,③ 燃煤时鼓入足量空气,④ 开发清洁能源。其中能减少酸雨产生的措施是………………( )
A. ①②③ B. ②③④
C. ①②④ D. ①③④
2.下列有关硅的说法,正确的是( )
A.硅具有金属光泽,所以是金属
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位
C.硅的化学性质不活泼,在自然界中主要以游离态形式存在
D.硅在电子工业中,是最重要的半导体材料
3.新型无机非金属材料与传统无机非金属材料的共同特性是 ( )
A 、耐高温 B、具有电学特性
C、具有光学特性 D、具有生物功能
4.某陨石中含有镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是( )
A. 12 B. 14 C. 16 D. 18
5.下列物质中,只存在共价键的是 ( )
A.MgCl2 B.NaOH C.H2O D.Na2O
6.下列化合物中,不能由相应单质直接化合得到的是( )
A、 FeCl3 B、H2Te C、SO2 D、 FeS
7.能把Na2SO3、Na2SO4、Na2SiO3三种无色溶液区分开的一种试剂是( )
A、Ba (OH)2 溶液 B、紫色石蕊试液 C、CaCl2溶液 D、盐酸
8.下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.CO2 B.H2O C.BF3 D.PCl5
9.下列说法正确的是
A向常用的加碘食盐中加入淀粉溶液,所得溶液呈蓝色
B向KI溶液中滴加入少量氯水,再加入少量CCl4没有明显现象
C向某溶液中加入BaCl2溶液,若产生白色沉淀说明原溶液中含有SO42-
D新制氯水可以使干燥的有色布条褪色
10.下列关于卤素的说法中,不正确的是
A单质的熔点和沸点随核电荷数的增加而升高
B单质的颜色随核电荷数的增加而加深
C单质的氧化性随核电荷数的增加而逐渐增强
D单质与氢气的反应随核电荷数的增加而逐渐变得困难
11.下列对浓H2SO4的叙述正确的是( )
A.浓H2SO4具有吸水性,故能使蔗糖炭化
B.浓H2SO4和木炭加热反应中,浓H2SO4表现出强氧化性
C.加热条件下,浓H2SO4与铁、铝不反应
D.浓H2SO4与亚硫酸钠反应制SO2时,浓H2SO4表现出强氧化性
12.高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是( )
A. 臭氧与氧气互称同素异形体.
B. 臭氧具有强氧化性,可以作脱色剂、消毒剂
C. 臭氧比氧气的氧化性更强,常温下能将Ag、Hg等较不活泼的金属氧化
D. 地球表面的臭氧层中含有大量臭氧,臭氧层对人类和地球生物有害,应该将其转变为氧气
13.下列反应的离子方程式中,正确的是 ( )
A. 氯气与水反应: Cl2 + H 2O==2H+ + Cl- +ClO-
B.Fe片投入稀H2SO4:2Fe + 6H+ = 2Fe3+ + 3H2↑
C. Cl2通入NaBr溶液:Cl2 + 2Br- == 2Cl- + Br2
D. 硫酸溶液与氢氧化钡溶液混合: SO42- + H+ + Ba2+ + OH-== BaSO4↓+ H2O
14.下列各组离子在溶液中能大量共存的是( )。
A.Ag+、K+、Cl—、NO3- B.Na+、S2—、SO32—、SO42—
C.Ba2+、H+、Cl—、SO42— D.K+、H+、S2—、SO32—
15.下列试剂保存方法正确的是( )
A.氢氧化钠溶液存放在玻璃塞的玻璃瓶中
B.溴水溶液存放在带玻璃塞的玻璃瓶中
C.氢氟酸保存在玻璃瓶中
D.漂白粉存放在敞口容器中
16.以NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.标准状况下,11.2 L三氧化硫中含有的分子数为0.5NA
B.2.8g Si完全溶解于足量KOH溶液中失去电子的数为0.2NA
C.1mol氟气与足量H2O反应生成的氧分子数为0.5NA
D.常温、常压下,11.2 L氯气所含原子数为NA
17.A、B、C为短周期中相邻三元素,A、B同周期,B、C同主族,已知此三种元素原子的最外层电子数之和为13,而其质子数之和为27,则此A、B、C三元素为( )
A.P、Si、C B.N、C、Si C.B、C、Si D.Al、Si、C
18.同周期的X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性强弱顺序是:
HXO 4>H2YO4>H3ZO4,则下列各判断中正确的是 ( B )
A.原子半径:X>Y>Z B.原子序数:X<Y<Z
C.气态氢化物稳定性:X<Y<Z D.元素的非金属性:X>Y>Z
19.下列说法中,不正确的是( A )
A.双原子分子中的共价键,一定是非极性键
B.非极性键也可能存在于离子化合物中
C. HCl溶解于水时化学键没有被破坏
D.共价化合物在液态时不能导电
20、硒是一种保健元素,含有硒元素的保健品现已进入市场。硒为第4周期第ⅥA族元素,根据它在元素周期表中的位置推测,硒元素不可能具有的性质是B
A.其单质在通常状况下是固体 B、H2Se比HBr稳定
C.硒的最高价氧化物的化学式为SeO3 D、硒元素常见化合价有-2、+4、+6三种
二、填空题(共24分)
21.(5分)(1)工业上制造普通玻璃的原料是 、 、
(2)高岭石的组成为Al2(Si2O5)(OH)4,若改用氧化物的形式表示其组成为
22.(8分)根据要求完成下列问题。
⑴写出氯气与消石灰反应制取漂粉精的化学方程式:_ 。
⑵用电子式表示NaCl 的形成过程:_ _ 。
⑶写出炭和浓硫酸在加热条件下反应的化学方程式:_ _。
(4)二氧化硅与炭在高温下反应制硅的化学方程式:_ _。
23. (11分) A、B、C、D四种短周期元素,原子序数D>C>B>A,且A、B、D同周期,A、D同主族,B的最外层只有1个电子,C的原子结构示意图为: , D在同周期主族元素中原子半径最小,据此填空:
, D在同周期主族元素中原子半径最小,据此填空:
(1)C的元素名称为 ,其气态氢化物的化学式为 ;
A元素在周期表中的位置是 。
(2)A、B、C、D四种元素的原子半径由大到小的顺序为(用化学式填写) ;
比较A-与B+的离子半径(用化学式填写) 。
(3)B和D最高价氧化物的水化物化学式分别为 和 。
(4)A、B、C、D四种元素中某些元素的化合物具有漂白性,试任写出其中两种具有该性质的化合物的化学式 、
(5)写出D的单质与B的最高价氧化物的水化物溶液反应的离子方程式:
三、简答题(13分)
24.(13分)已知A-F是中学化学中常见物质,其中A、D为气体,且A是一种具有刺激性气味的、易溶于水的无色气体,C、E分别为两种酸,E的浓溶液与F共热通常用于实验室制备D,F是一种黑色粉末。(反应中部分生成物已略去)
另外作图
试回答下列问题:
(1)写出反应③的离子方程式: ;
(2)根据图中信息判断,A、D、F氧化性从强到弱的顺序是
(3)H2O2的电子式为 ;H2O2既具有氧化性又具有还原性,已知H2O2的氧化性介于A和D之间,请写出A、D分别与H2O2溶液反应的化学方程式:
、
(4) C能与水反应生成一种强酸和一种弱酸,此弱酸的酸性比碳酸 (填“强”或“弱”),能证明此结论的化学方程式为 。
四、实验题(13分)
25(6分)、为了比较硫与碳的非金属性的强弱,某同学想通过比较两种元素的最高价氧化物对应的水化物的酸性强弱来验证硫与碳的非金属性的强弱,采用了下图中的甲、乙装置:
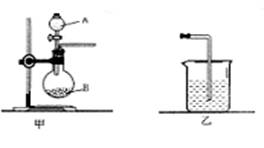
①.仪器A的名称是___________,仪器B中应盛放的药品是________,装置乙中应盛放的药品是___________。
②.B中发生反应的离子方程式为:______________________________;
在装置乙中观察到的现象是:_______________________________。
26.(7分)有同学用铜丝代替铜片改进教科书中浓硫酸与铜反应的实验,以便随时从反应液中抽出铜丝停止反应(如图):

⑴浓硫酸与铜反应的化学方程式为: 。
⑵试管乙中装的是品红溶液,其反应过程中观察到的现象是: ;
若试管乙中装的是石蕊溶液,则反应过程中观察到的现象是: 。
若试管乙中装的是溴水,则反应的离子方程式为: 。
⑶反应结束后在试管甲的底部常可见到—些白色固体,该固体可能是 (填化学式)。
(4)装置中喷有少量碱液的棉花的作用是 。
五、计算题(共10分)
27.(4分)向500 mL KI溶液中通入足量Cl2反应后,蒸发溶液,灼烧固体,最后剩下7.45 g固体,则原KI的物质的量浓度是 ;参加反应的Cl2的体积(标准状况下)为 。
28.(6分)向铜片中加入115 mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500 mL,再加入足量锌粉,使之充分反应,收集到2.24 L(标准状况)气体。过滤残留固体,干燥后称量,质量减轻了7.5 g。求原硫酸的物质的量浓度。
高一化学期末试题 2006.07
参考答案及评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | A | C | C | B | D | A | D | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | D | C | B | B | C | B | D | A | B |
二、填空题(共24分)
21(共5分)(1)石英、石灰石、纯碱 (3分)
(2)Al2O3·2SiO2·2H2O (2分)
22(每空2分,共8分)(1) 2Cl2 + 2 Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O
(2) 
(3) C + 2H2SO4![]() 2SO2↑+ CO2↑+ 2H2O
2SO2↑+ CO2↑+ 2H2O
(4)
SiO2 + 2C ![]() Si + 2CO
Si + 2CO
23(共11分)(1)硅,SiH4 ,3周期ⅦA (每空1分,共3分)
(2) Na > Si > Cl > F ;F-> Na+ (每空1分,共2分)
(3) NaOH HClO4(每空1分,共2分)
(4) HClO Ca(ClO)2 NaClO Na2O2(任写两种,每空1分,共2分)
(5)Cl2+2OH-===Cl-+ClO-+H2O (2分)
三、简答题(共12分)
24(共12分)(1) MnO2 + 4H+ +2Cl-
![]() Mn2+ + Cl2↑+ 2H2O (2分)
Mn2+ + Cl2↑+ 2H2O (2分)
(2)F > D> A (或MnO2 > Cl2 > SO2) (2分)
(3) (1分)
H2O2 + SO2 =H2SO4 (2分)
H2O2 + Cl2 = 2HCl + O2 (2分)
(4) 弱(1分) ; Ca(ClO)2 + CO2 +H2O = CaCO3↓+2HClO(或其它合理答案)(2分)
四、实验题(共14分)
25(共6分)分液漏斗(1分);稀硫酸(1分);澄清石灰水(1分)
HCO3-+H+=H2O+CO2↑(2分);澄清石灰水变浑浊(1分)
26(共8分)⑴Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+ 2H2O(2分)
CuSO4 + SO2↑+ 2H2O(2分)
(2) 品红溶液溶液褪色(1分);紫色变为红色(1分)
Br2 + SO2 + 2H2O == 4H+ + SO42- + 2Br-(2分)
(3) CuSO4(1分)
(4)吸收SO2,防止其污染空气。(1分)
五、计算题(共10分)
27(共4分)解:由题意可知,最后剩余的7.45 g固体应为KCl,
所以n(KI)=2n(Cl2)=n(KCl)=
![]() =0.1 mol,
=0.1 mol,
所以c(KI)=![]() =0.2 mol·L -1,V(Cl2)=
=0.2 mol·L -1,V(Cl2)=![]() ×0.1 mol×22.4 L·mol-1=1.12 L。
×0.1 mol×22.4 L·mol-1=1.12 L。
答案:0.2 mol·L-1(2分) 1.12 L(2分)
28(共6分)
解:根据S元素守恒:n(H2SO4)=n(ZnSO4)+n(SO2),n(H2)=0.7 mol。 (1分)
所以,与H2SO4反应生成H2的Zn的物质的量为:n(Zn)=0.7 mol,
参与反应的锌的质量为:m(Zn)=45.5 g。 (1分)
CuSO4 + Zn===Cu + ZnSO4 Δm
1 mol 65 g 64 g 1mol 1 g
a b 46.2g-45.5 g=0.7g
所以,a= 0.7mol, b=0.7mol。 (2分)
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
已知n(CuSO4)= 0.7mol,故有n(SO2)= 0.7mol。
故n(H2SO4)=n(ZnSO4)+n(SO2)= 0.7mol+0.7 mol+0.7 mol=2.1 mol, (1分)
c(H2SO4)= =18.3 mol·L-1。
(1分)
=18.3 mol·L-1。
(1分)
答:略
(其它合理解法同样给分)