苏教版必修1专题3 第一单元课时练习2 铝的氢氧化物(A卷)
一、选择题
1.下列物质既能跟盐酸反应,又能跟NaOH溶液反应的是 ( )
A.Al2O3 B.NaAlO2 C.Mg(OH)2 D.NaHCO3
2.下列物质中既能跟盐酸反应,又能跟氢氧化钠溶液反应的是 ( )
A.Al(OH)3 B.Fe2O3 C. K2SO4溶液 D.CO2
3.向NaAlO2 溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是 ( )
A、HCl B、CO2 C、NH3 D、CO
4.将少量的金属钠投入到过量的AlCl3溶液中,产生的现象是 ( )
A.只有气体产生 B.生成白色沉淀
C.生成无色透明溶液 D.产生气体和白色沉淀
5.现有200 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-)=1.3mol·L-1,要使Mg2+转化为Mg(OH)2,并使与Al3+分开,至少需要4 mol·L-1的NaOH溶液的体积为 ( )
A.140 mL B.120 mL C.100 mL D.80 mL
6.把X溶液逐滴滴入Y溶液中,与把Y溶液逐滴滴入X溶液中,所产生的现象不同的是 ( )
| A | B | C | D | |
| X | BaCl2 | HCl | NaOH | FeCl3 |
| Y | H2SO4 | NaAlO2 | MgCl2 | NaOH |
7.向l0 mL1 mol·L-1AlCl3溶液中加入l mol·L-1NaOH溶液生成沉淀0.26g.则所加NaOH的体积为 ( )
A.10 mL B.20 mL C.30 mL D.36.7 mL
8.在他Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度等于0.4mol/L,当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是 ( )
A.0.2mol/L B.0.05mol/L C.0.45mol/L D.0.225mol/L
二、填空题
9.将一块镁铝合金先溶解在盐酸中,再加入过量的NaOH溶液,发生反应的离子方程式依次是⑴ ;⑵ ;
⑶ ;⑷ ;
⑸ ;
10.某无色溶液能与铝粉反应放出H2,试分析在H+、Ba2+、Mg2+、OH-、NO3-、Cl-等离子中可能有哪些离子大量存在于此溶液中:
⑴如果有 离子存在,还可能有 离子。
⑵如果有 离子存在,还可能有 离子。
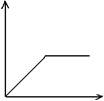
11.从下列图象中选出正确的选项(纵坐标表示沉淀的物质的量,横坐标表示所加试剂的物质的量)
(1) 往HCl和AlCl3混合溶液中滴加NaOH溶液至过量 ( )
(2) CO2通入NaAlO2溶液中至过量 ( )
(3) 往NaAlO2溶液中滴加盐酸至过量 ( )
(4) 往MgCl2和AlCl3混合溶液中滴加NaOH溶液至过量 ( )
|
|
|
|



三、计算题
12.将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加入50mL 1 mol·L一1的盐酸,可恰好使反应过程中产生的沉淀消失。求原混合物中铝、过氧化钠各多少克?
苏教版必修1专题3 第一单元课时练习2 铝的氢氧化物(A卷)答案
一、选择题
1.AD 2.A 3.A 4.D 5.D 6.B 7.AD 8.B
二、填空题
9.答案:略
10.⑴H+ Ba2+、Mg2+、Cl- ⑵OH- Ba2+、NO3-、Cl-
11.(8分) ⑴D ⑵A ⑶B ④C
三、计算题
12..解:有关反应为:2Na2O2+2H2O=4NaOH+O2↑ 2Al+2NaOH+2H2O=2NaAl02+3H2↑ NaAlO2+HCl+H2O=Al(OH)3↓+NaCl A1(OH)3+3HCl3+3HCl=AlCl3+3H20
最终溶液中所含溶质为NaCl、AlCl3,设NaCl、AlCl3的物质的量分别为x mol,ymol,则Na2O2、Al的物质
的量分别为 ,依题意有:

