启东市2005---2006学年度第一学期期终学生素质测试
高一化学试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷总分100分。答卷时间100分钟。考试结束,将第II卷和答题卡一并交回。
第Ⅰ卷(选择题 共48分)
注意事项:
1.回答I卷前,考生务必在答题卡的姓名、考试号、科目名称等汉字、数字用钢笔或圆珠笔填写正确,并用2B铅笔填涂考试号。
2.每小题选出正确答案后,用2B铅笔把答题卡上对应的选中项涂满涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。如将答案写在试题卷上,一律不给分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32
Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 I-127 Ba-137
一、选择题(本题包括12小题,每小题2分,共24分。每小题只有一个选项符合题意)
1.下列说法正确的是
A. 煤的干馏是物理变化
B. 石油裂解的主要目的是制备更多的汽油
C. 石油分馏能得到不同沸点范围的产物, 每一种馏分都是多种烃的混合物
D. 煤中含有苯、甲苯等,可以用干馏后再分馏的方法把它们分离出来
2. 在m A + n B ![]() p C的反应中,m、n、p为各物质的计量数。现测得C每分钟
p C的反应中,m、n、p为各物质的计量数。现测得C每分钟
增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为
A、2:3:2 B、2:3:3 C、1:3:2 D、3:1:2

3.某学生发现滴瓶中溶液里有悬浊物,拟用右图所示操作进行过滤,错误的操作有( )
A.4处 B.3处
C.2处 D.1处
4.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
A.45g水中含有的水分子数是2.5NA
B.标准状况下,33.6LCO中含有的原子数是3NA
C.0.5L0.2mol/L的NaCl (aq)中含有的Na+数是0.1NA
D.1molCH3+(碳正离子)中含电子数目为10NA
5.下列叙述中正确的是 ( )
A.金属阳离子被还原一定得到金属的单质
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.含金属元素的离子不一定都是阳离子
6. X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出, X 与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为: ( )
A X>Y>Z B X>Z>Y C Y>X>Z D Y>Z>X
7.下列各组离子在强碱性溶液中大量共存,且溶液呈无色透明的是( )
A、K+、MnO4-、Cl-、SO42- B、Na+、AlO2-、NO3-、CO32-
C、Na+、H+、NO3-、Cl- D、Na+、SO42-、HCO3-、Cl-
8.有关乙烯有下列叙述:①乙烯溶于水后可得乙醇 ②乙烯能发生加聚反应 ③乙烯能与溴水发生加成反应 ④乙烯是无色无味难溶于水的气体 其中正确的是:------- ( )
A、只有② B、①和③ C、②和③ D、②③④
9.下列4种化合物分别经催化加氢后,不能得到2—甲基戊烷的是----------------- ( )
①CH3CH=C(CH3)CH2CH3 ②CH3CH2CH=CHCH2CH3 ③CH2=C(CH3)CH2CH2CH3
④CH3CH=CHCH(CH3)CH3
A、①② B、③④ C、①③ D、②④
10. 下列数据是有机物的式量,其中可能互为同系物的一组是 ( )
A.16、30、42、56 B.16、28、40、52
C.16、32、48、54 D.16、30、58、72
11. 对于某些离子的检验及结论一定正确的是( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
12.在10℃时某化学反应速率为0.1 mol/(L•s),若温度每升高10℃反应速率增加到原来的
2倍。为了把该反应速率提高到1.6 mol/(L•s),该反应需在什么温度下进行?( )
A、30℃ B、40℃ C、50℃ D、60℃
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
13.下列实验操作中,正确的是( )
A.为了使过滤速率加快,可用玻棒在过滤器中轻轻搅拌,加速液体流动
B.用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上
C.为加速固体物质的溶解可采用粉碎、振荡、搅拌、加热等方法
D.为增大气体物质的溶解度,常采取搅拌、加热等措施
14. 下列说法中错误的是( )
A.原子及其离子的核外电子层数等于该元素所在周期数
B.元素周期表中从ⅢB族到ⅡB族10列的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8个
D.同一元素的各种同位素的物理性质和化学性质完全相同
15.下列离子方程式中,书写正确的是( )
A、碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+CO2↑
B、二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+ H2O
C、硅酸和氢氧化钾溶液反应:H2SiO3+2OH-=SiO32-+2H2O
D、饱和碳酸钠溶液中通入过量的CO2:CO32-+H2O+CO2=2HCO3-
16.某物质在酸性条件下可以发生水解反应生成两种物质A、B,且A和B的相对分子质量相等,该物质可能是 ( )
A. 葡萄糖 B.硬脂酸甘油酯
C. 甲酸乙酯(HCOOC2H5) D.淀粉
17. 从原子序数11依次增加到17,下列所叙递变关系错误的是( )
A.电子层数逐渐增多 B.原子半径逐渐增大
C.最高正价数值逐渐增大 D.从硅到氯负价从-4→-1
|
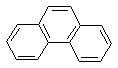
其分子式为
A. C14H10 B. C14H22
C. C18H30 D. C16H26
19.在反应3BrF3+5H2O=HBrO3+9HF+Br2+O2↑,若有0.3molH2O被氧化,则被水还原的BrF3的物质的量是 ( )
A.0.15mol B.0.2mol C.0.3mol D.0.4mol
20.把ag铁铝合金粉末溶于足量的稀盐酸中,再向所得溶液中加入过量的NaOH溶液充分搅拌过滤,将得到的沉淀洗涤、干燥、灼烧,最后得到ag红棕色粉末。则原合金中铝的质量分数为
A.70% B.30% C.47.6% D.52.4%
第Ⅱ卷(非选择题 共52分)
| 题 号 | 三 | 四 | 五 | 六 | 总 分 | 结分人 |
| 得 分 |
|
|
|
|
|
|
| 得分 | 评卷人 |
三、本题包括2小题,共14分
21.(5分) 海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里 从海带中提取碘的流程如下:
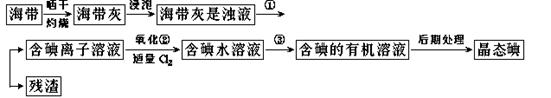 (1)指出提取碘的过程中有关的实验操作名称:①
,③
。
(1)指出提取碘的过程中有关的实验操作名称:①
,③
。
写出过程② 中有关反应的离子方程式: 。
(2)提取碘的过程中,可供选择的有机试剂是( )。
A.甲苯、酒精 B.CCl4、苯
C.汽油、乙酸 D.裂化气油、苯
(3)为使海带灰中碘离子转化为碘的有机溶液,实验室里的烧杯、玻棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,仍缺少的玻璃仪器 。
22.(9分)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
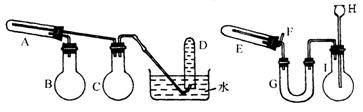
请填写下列空白:
(1)实验进行时试管A中应加入的试剂是 ;烧瓶B的作用是 ,烧瓶C的作用是 。
(2)实验时,U型管G中应加入的试剂是 ;长颈漏斗H中应加入 。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母) 。
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是 。
(5)试管E中发生反应的化学方程式是 。
(6)为了安全,在E管中的反应发生前,在F出口处必须 。
| 得分 | 评卷人 |
四、本题包括2小题,共14分
23.(5分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号 ;D的原子结构示意图 。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是 。
(3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中各原子都满足最外层8电子结构的是 (填写具体的化学式 )。
(4)CA2与D元素的单质在水溶液中反应的化学方程式是 。
24.(9分)我国在许多城市试用新的汽车燃料——车用乙醇汽油。乙醇,俗名酒精,它是以玉米、小麦、薯类等为原料经发酵、蒸馏而制成的。乙醇进一步脱水,再加上适量汽油后形成变性燃料乙醇。而车用乙醇汽油就是把变性燃料乙醇和汽油按一定比例混配形成的车用燃料。结合有关知识,回答以下问题:
(1)汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5~C11范围内,如戊烷,其结构简式及其同分异构体分别为__________、__________、__________。
(2)乙醇可由含淀粉〔(C6H10O5)n〕的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制乙醇的化学方程式:
(3) 司机是否酒后驾车,可通过对其呼出的气体进行检验而查出,所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4===Cr2(SO4)3(绿色)+3CH3CHO+6H2O
上述反应中的氧化剂是__________,还原剂是__________。
| 得分 | 评卷人 |
五、本题包括2小题,共12分
25、(4分)写出由乙烯为原料制取乙酸乙酯的反应方程式
 |
26、(8分) 由单质A与化合物B两种粉未组成的混合物,在一定条件下可按下图所示发生转化:
请回答:
(1)反应①的化学方程式
实验室进行该反应时还需要两种试剂是
(2)反应②的离子方程式
(3)反应④的离子方程式
| 得分 | 评卷人 |
六、本题包括2小题,共12分
27、(6分) 取标准状况下CH4和过量O2的混合气体840mL,点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600g。计算:
(1)碱石灰吸收后所剩气体的体积(标准状况下)
(2)原混和气体中CH4跟O2的体积比
28、(6分)孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成,写出化学式。
孔雀石__________________________;石青__________________________;
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比。
2005~2006学年度第一学期期末教学调研
高一化学参考答案
一、选择题(本题包括12小题,每小题2分,共24分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| C | C | A | D | D | C | B | D | A | D | C | C |
二、选择题(本题包括8小题,每小题3分,共24分)
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BC | AD | BC | C | AB | A | B | B |
三、本题包括2小题,共14分
21、(5分).(1)过滤,萃取,Cl2+2I-=I2+2Cl- (2)B (3)分液漏斗 (各1分)
22、(9分)(1)普通铁粉,产生水蒸气,防止倒吸, (2)碱性固体干燥剂 6 mol/L HCl
(3) A,B,E (4)加快H2产生速度 (5)Fe3O4+4H2=3Fe+4H2O (6)检验H2纯度,(各1分)
四、本题包括2小题,共14分
23、(5分) (1)O Cl的原子结构示意图 ,(2)S2- > O2- > Na+
(3)Na2O2,SCl2,Cl2O (4)SO2 +Cl2 + 2H2O = 2HCl + H2SO4 (各1分)
24、(9分)(1) CH3—CH2—CH2—CH2—CH3 CH3CH(CH3)CH2CH3 C(CH3)4(各1分)
(2)①(C6H10O5)n+nH2O![]() nC6H12O6 C6H12O6→2CO2+2C2H5OH(各2分)
nC6H12O6 C6H12O6→2CO2+2C2H5OH(各2分)
(3) CrO3 C2H5OH (各1分)
五、本题包括2小题,共12分
25、(4分)CH2=CH2+H2O ![]() CH3CH2OH,
CH3CH2OH,
2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
2 CH3CHO+O2![]() 2CH3COOH
2CH3COOH
|
CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O
(各1分)
CH3COOC2H5+H2O
(各1分)
26、(8分)(1)![]() 镁条、氯酸钾
镁条、氯酸钾
(2)![]()
(3)![]() (各2分)
(各2分)
六、本题包括2小题,共12分
27、(1)剩余气体的体积336mL (2)V(CH4):V(O2)=1:4 (各3分)
28、(1)孔雀石的化学式为 CuCO3•Cu(OH)2
石青的化学式为 2CuCO3•Cu(OH)2
(2)孔雀石与石青物质的量之比为1:1(各2分)