桂城中学05-06上高一级化学科期末测试题
可能用到的相对原子质量:H -1 C-12 O- 16 N- 14 Na- 23 Al-27 S- 32 Cl- 35.5 Fe -56 Cu -64
一、选择题:(共15小题,每小题只有一个选项符合题意,每小题3分,共45分)
1、下列物质不是电解质的是
A、Na2SO4 B、 NaOH C、O2 D、HCl
2、下列物质中,按其成分能与玻璃、水泥、陶瓷归于同一类的是
A.硅石 B.碳化硅 C.硅酸钠 D.二氧化硅
3、下列物质焰色反应不为黄色的是
A、NaCl 溶液 B、NaOH C、 Na D、KCl 溶液
4、下列关于浓硫酸的叙述正确的是
A、浓硫酸具有吸水性,因而能使蔗糖炭化
B、浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C、浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D、浓硫酸在常温下能够使铁、铝等金属钝化
5、下列各组中的离子,能在溶液中大量共存的是
A、H+ Na+ CO32- Cl- B、Ba2+ Na+ Cl- SO42-
C、K+ H+ SO42- OH- D、Ag+ Al3+ NO3- H+
6、为高空或海底作业提供氧气的是物质
A、KClO3 B、KMnO4 C、Na2O2 D、H2O
7、下列各溶液中,Na+物质的量浓度最大的是
A、4L 0.5mol/L NaCl溶液 B、1L
0.3mol/L Na2SO4溶液
C、5L 0.4mol/L NaOH D、2L 0.15mol/L
Na3PO4
8、下列叙述正确的是
A、1mol任何气体的体积一定是22.4L
B、同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C、在标准状况下,体积为22.4L的物质都是1mol
D、在非标准状况下,1mol任何气体的体积不可能是22.4L
9、把10.6gNa2CO3溶于水中配成1L溶液,从中取出50ml ,则所得溶液物质的量浓度为
A、1mol/L B、0.1mol/L C、0.5mol/L D、不能确定
10、将盛有N2和NO2 的混合气体的试管倒立于水中经过足够时间后,气体体积减少为原来的一半,则原混合气体中N2和NO2 的体积比是
A 1:1 B 1:2 C 1:3 D 3:1
11、某合金与铁的物理性质的比较如下表所示:
|
| 熔点/℃ | 密度(g/cm3) | 硬度(金刚石为10) | 导电性(银为100) |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
还知该合金耐腐蚀,强度大。从以上性能看,该合金不适合作
A、 导线 B、门窗框 C、 炉具 D、飞机外壳
12、0.5L 1mol/L FeCl3溶液与1.5L 1mol/L KCl溶液混合,混合液中Cl-的物质的量浓度(假设混合时溶液的体积不变)
A、1 mol/L B、2 mol/L C、1.5 mol/L D、3 mol/L
13、下列关于新制氯水及久置氯水的说法,不正确的是
A、新制的氯水呈黄绿色,久置的氯水无色
B、新制的氯水漂白作用强,而久置的氯水漂白作用很弱
C、新制的氯水所含成分多,而久置的氯水所含成分少
D、新制的氯水中无氯离子,而久置的氯水中则含氯离子
14、下列反应的现象描述与离子方程式都正确的是
A、金属镁与稀盐酸反应,有氢气产生:Mg + 2H++ 2Cl— == MgCl2 + H2↑
B、氯化钡溶液与硫酸反应,有白色沉淀产生;Ba2+ + SO42— == BaSO4↓
C、碳酸钠溶液与盐酸反应,有气泡逸出;Na2CO3 +2H+ == 2Na+ + H2O + CO2↑
D、过量铁粉与氯化铁溶液反应,溶液变浅绿色;Fe + Fe3+ == 2Fe2+
15、铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A、1:1 B、2:1 C、3:1 D、1:3
二、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
16、下列物质存放方法错误的是
A、铝片长期放置在不密封的纸盒里 B、漂白粉长期放置在烧杯中
C、FeSO4溶液存放在加有少量铁粉的试剂瓶中 D、氢氟酸贮放在玻璃瓶里
17、含碘食盐中的碘是以碘酸钾(KIO3)形式存在的。已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O。现有下列物质①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液。利用上述反应,可用来检验含碘食盐中含有IO3-的是
A、②④ B、①③ C、②③ D、①④
18、下列说法正确的是:
A、Cl-和Cl2都是氯元素 B、Cl2有毒, Cl-没有毒
C、Cl-离子比Cl原子多一个质子 D、Cl2和Cl原子都呈黄色
19、将21.8gNa2O2与Na2O的混合物投入足量的水中溶解,称得水溶液增重18.6g,则原混合物中Na2O2与Na2O的物质的量之比是
A、1:1 B、1:2 C、2:1 D、2:3
20、将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是
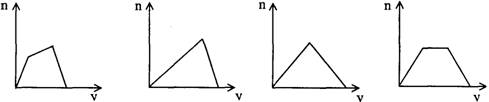
A B C D
三、填空题:(本题共5小题,共32分。)
21、(2分)区分胶体与溶液的方法是________________________________
22、(4分)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C![]() 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
|

⑴写出下列物质的化学式:B D G X
⑵写出下列反应的化学方程式:反应①
反应②
24、(7分)某研究性学习小组设计了如下图所示的实验,以此来验证氯、溴、碘三种
 卤素单质的氧化性顺序。图中A、B、
卤素单质的氧化性顺序。图中A、B、
C分别是浸有饱和溴化钠溶液、饱和
碘化钾溶液、冷水的棉球,烧杯D中
盛有氢氧化钠溶液。实验时,从左端导管口缓慢通入氯气,待B处出现明显现象时再对B棉球进行加热。请利用资料卡片提供的信息,结合所学知识,完成下列问题:
资料卡片
| 卤素单质 | 颜色和状态 | 蒸气颜色 | 在水中的溶解度 | 水溶液的颜色 | 熔点 /℃ | 沸点 /℃ |
| Cl2 | 黄绿色气体 | 在一定量水中溶解的溶质的物质的量逐渐减少 | 淡黄绿色 | -101 | -34.6 | |
| Br2 | 深红棕色液体 | 红棕色 | 橙红色 | -7.2 | 58.78 | |
| I2 | 紫黑色固体 | 紫色 | 黄褐色 | 113.5 | 184.4 |
(1)棉球A的现象:
(2)棉球B上反应的离子方程式:
(3)棉球C的现象:
(4)氢氧化钠溶液的作用是: ,写出其中一反应的离子方
程式:
25、(11分)为了验证Cu和 浓H2SO4反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置 . B中有无水硫酸铜、C中有品红、D中有氢氧化钠溶液
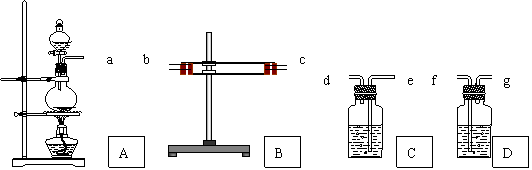
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):a接 ,
接 , 接 ;
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O?
B中 ,C中 ;
若将 B、C装置前后对调,对实验有何影响
(3)D中氢氧化钠溶液的作用是 ;
(4)写出A中反应的化学方程式 .
四、计算题(8分)
26、(8分)取18.55g的NH4Cl和Na2SO4固体混合物,加水完全溶解后,加入50mL的NaOH溶液后加热,恰好反应完得到6.72L的氨气(在标准状况下),试计算固体混合物中NH4Cl的质量和NaOH溶液的物质的量浓度。
桂城中学05-06上高一级化学科期末测试题
答案
一、二题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| C | C | D | D | D | C | B | B | B | C | A | C | D |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | ||||||
| B | C | BD | B | B | C | D |
三、填空题(4小题,共 32分)
21、(2分)丁达尔现象
22、(4分,每空2分)① H2O + AlN + NaOH ==NaAlO2 + NH3 ↑
②61.5%
23、(8分) ⑴B Fe3O4 D FeCl3 G H2 X H2O(g) (每空1分)
⑵4Fe(OH)2+O2+2H2O=4Fe(OH)3
3Fe+ 4H2O(g)= Fe3O4 +4H2↑ (每空2分)
24.(7分) 方程式为2分,其余均每空为1分
(1)由白色逐渐变为橙红色直至红棕色,并冒出红棕色气体。
(2)Br2+2I-=2Br-+I2 或Cl2+2I-=2Cl-+I2
(3)由白色逐渐变为黄褐色直至紫黑色,
(4)吸收尾气防止污染环境, Cl2+2OH-=Cl-+ClO-+H2O
25、(11分) 方程式为2分,其余均每空为1分
(1) a接 b(或c) , c(或b) 接 e , d 接 f ;
(2) B中 白色粉末变蓝 ,C中 品红褪色 ;
如果C装置放在B之前,则 不能检验出反应是否有水生成 。
|
(4)写出A中反应的化学方程式 2H2SO4(浓)+ Cu ====== CuSO4+SO2↑+2H2O 。
四、计算题(共8分)
26、(8分)解:NH4Cl
+ NaOH ![]() NaCl + NH3↑ + H2O (2分)
NaCl + NH3↑ + H2O (2分)
1mol 1mol 22.4L
n(NH4Cl) n(NaOH) 6.72L
(1) NH4Cl的物质的量为:n(NH4Cl)=0.30mol
m(NH4Cl)= 0.3mol × 53.5g/mol = 16.05g(2分)
(2)反应中消耗NaOH的物质的量n(NaOH)= 0.30mol (2分)
则所得溶液中NaOH的物质的量浓度为:
c(NaOH)=0.30mol÷0.05L = 6mol·L-1 (2分)
答:铜片的质量为16.05g,所得溶液中硫酸铜的物质的量浓度为6mol·L-1