期末复习综合练习题(2)
有关的原子量:H:1, O:16, Na:23, S:32, Cl:35.5,
K:39, Fe:56, Mn:55, Ba:137, Cu:64,
Ag:108
一、选择题(20分,每小题2分,每小题只有一个选项符合题意)
1、在通常状况下,下列气体在水中的溶解度最大的是
A.氯气 B.氯化氢 C.二氧化硫 D.硫化氢
2、实验室中制备下列各组气体,所用气体发生装置相同的是
H2和CO2 ‚SO2和O2 ƒHCl和Cl2 „CO2和HCl …SO2和Cl2
A.ƒ B.„ C.‚„ D.‚…
3、向品红溶液中分别加入(或通入)下列各物质,不能使品红溶液褪色的是
A.SO2 B.H2S C.Cl2 D.活性碳
4、熟石膏的化学式为
A.ZnSO4·7H2O B.CaSO4·2H2O
C.2CaSO4·H2O D.Na2SO4·10H2O
5、实验室用浓硫酸制取HCl气体,是因为浓硫酸是
A.脱水剂 B.干燥剂 C.强酸 D.难挥发强酸
6、在下列反应中,属于氧化还原反应,但水既不是氧化剂,也不是还原剂的是
A.氯气和水 B.氟气和水 C.三氧化硫和水 D.电解水
7、下面是几条规律的叙述:
原子半径增大
‚元素氢化物的稳定性减弱
ƒ元素单质的还原性增强
„元素单质的导电性由绝缘体à半导体à导体
完全符合上述规律的元素组是
A.O、S、Se B.S、Se、Te
C.Cl、Br、I D.S、Cl、Br
8、下列叙述中,不能证明氯元素的非金属性比硫元素强的是
A.适量氯气通入硫化氢溶液中可置换出硫
B.受热时硫化氢可以发生分解,而氯化氢在高温下也难分解
C.单质与铁反应时,分别生成氯化铁和硫化亚铁
D.氢硫酸是弱酸,而盐酸是强酸
9、下列离子方程式不正确的是
A.硫化氢气体通入硝酸铅溶液:![]()
B.向氢氧化钾溶液中通入过量的SO2:![]()
C.氯气与水反应:![]()
D.将Fe投入硝酸银溶液中:![]()
10、需要加入还原剂才能实现的变化是
A.Cl-àCl2 B.MnO2àMn2+ C.S2-àS D.F-àHF
二、选择题(30分,每小题2分,每小题有1—2个选项符合题意)
11、通常状况下,有等体积的下列气体相互混合后,体积最小的是
A.Cl2和HCl B.H2S和SO2 C.SO2和O2 D.H2和F2
12、下列反应中二氧化硫被氧化的是
A.![]()
B. ![]()
C. ![]()
D.![]()
13、向某盐溶液中通入过量Cl2,再滴加Ba(NO3)2溶液和稀HNO3,溶液中有白色沉淀生成,该盐可能是
A.Na2SO3 B.CaCl2 C.AgNO3 D.Na2CO3
14、由于易被氧化而变质,实验室中不易长期存放的是
A.亚硫酸钠溶液 B.氢硫酸 C.漂白粉溶液 D.烧碱溶液
15、下列实验现象描述正确的是
A.红热的铜丝在氯气中燃烧,产生棕黄色的烟
B.点燃的红磷在氯气中继续燃烧,产生白色的烟
C.硫化氢在充足的空气中燃烧,发生淡蓝色火焰,生成有刺激性味的气体
D.溴水中加入少量汽油振荡,静置后,上层溶液颜色变浅,下层溶液为橙红色
16、常温下,下列各组微粒在溶液中能大量共存的是
A.Cu2+和S2- B.Br2和SO2
C.![]() D.
D. ![]()
17、下列洗涤不洁净的玻璃仪器的方法错误的是
A.做过碘升华实验的烧杯壁有碘附着,用酒精洗涤
B.做高锰酸钾分解实验的的试管壁有二氧化锰附着,用浓盐酸洗涤
C.做铜丝在硫蒸气中燃烧实验的试管壁有单质硫附着,用二硫化碳洗涤
D.盛放石灰水的试剂瓶内壁上的白色斑迹用烧碱溶液洗涤
18、工业上从含硒的废料中提取硒的方法之一是用硫酸和硝酸钠处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸被转化为亚硒酸![]()
![]()
![]() 将SO2通入亚硒酸的溶液中,单质硒即析出,据此,下列叙述正确的是
将SO2通入亚硒酸的溶液中,单质硒即析出,据此,下列叙述正确的是
A.H2SeO4氧化性弱于Cl2
B.亚硒酸氧化性强于亚硫酸
C.SeO2的还原性强于SO2
D.析出1mol Se,需H2SeO3、SO2、H2O各1mol
19、氯酸钾和二氧化锰混合后充分加热,残留物经冷却加入浓硫酸,再加热,此时产生的气体是
A.只有O2 B.只有SO2 C.只有HCl D.Cl2和HCl
20、物质的量相等的下列物质,与足量浓H2SO4反应,生成SO2最多的是
A.C B. S C.Cu D.Na2SO3
21、能用![]() 来表示的化学反应是
来表示的化学反应是
A.FeS和稀盐酸反应 B.NaHS和稀硫酸反应
C.K2S和稀盐酸反应 D.K2S和次氯酸反应
22、既能使品红溶液褪色,又能使溴水褪色的是
A.SO2 B.H2S C.Cl2 D.HI
23、VL硫酸铁溶液中含Fe3+ag,则溶液中![]() 物质的量浓度为
物质的量浓度为
A.![]() B.
B. ![]()
C. ![]() D.
D. ![]()
24、在质量为Gg的坩埚中,放入BaCl2·nH2O晶体后称重为W1g。加热使结晶水全部失去,冷却后,称得剩余物与坩埚的质量为W2g。则n值为
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
25、在反应![]() 中,当有11mol电子转移时,反应前后固体物质减少的质量为
中,当有11mol电子转移时,反应前后固体物质减少的质量为
A.160g B.80g C.128g D.40g
26、有一瓶无色气体,可能含有CO2、H2S、HCl、SO2和HBr中的一种或几种,现实验如下:
(1)加入适量氯水,振荡、静置得无色透明溶液,然后分为两份;
(2)向一份中加入用盐酸酸化的BaCl2溶液,出现白色沉淀物,另一份中加入硝酸酸化的硝酸银溶液,也产生白色沉淀物。由此可得出正确的推论是
A.可能含有HBr和CO2 B.一定有HCl和SO2
C.一定无H2S和CO2 D.一定无HBr和H2S
三、填空题(共30分)
27、实验室中常用36.5%的浓盐酸,密度为1.2g/cm3,其物质的量浓度为 mol/L,现要配制3mol/L的稀盐酸100mL,需这种浓盐酸 mL。从所配好的稀盐酸100mL中取出15mL,加入2mol/L的NaOH溶液 mL,才能恰好中和。
28、某溶液中含有Na2SO4、Na2CO3、NaOH、NaCl四种溶质,如果只允许取一次该溶液,分别将这四种物质电离出的![]() 检验出来(允许使用必要的实验操作如过滤),那么应:
检验出来(允许使用必要的实验操作如过滤),那么应:
(1)先检验 ,加入试剂为
(2)然后检验 ,加入试剂为
(3)再检验 ,加入试剂为
(4)最后检验 ,加入试剂为
29、写出或配平下列化学方程式:
(1)铜片浓硫酸共热
(2) K2Cr2O7 + HCl = + KCl + CrCl3 + Cl2+ H2O
30、将Na2S、Na2SO3、Na2SO4按一定比例混合配成溶液,做如下实验:
(1)混合溶液与过量的某无氧酸甲反应,得浅黄色沉淀A和无色溶液B;
(2)无色溶液B与某硝酸盐溶液乙反应,得白色沉淀C和溶液D;
(3)在溶液D中加入某硝酸盐溶液丙,得黄色沉淀E,再加入少量稀硝酸,E不溶解。
写出下列物质的化学式:甲: 乙: A: C: E:
写出以上三步实验中反应的离子方程式:
(1) (2) (3)
四、实验题(13分)
31、下图是实验室中某学生设计用来制取干燥纯净氯气的装置,由于有错误而不能在D集气瓶中收集到氯气。请指出装置中的错误,加以改正,并回答下列问题:(A中试剂为二氧化锰和稀盐酸,B中为食盐饱和溶液,C中为浓硫酸)
(1)装置中的错误并改正:
|
|
‚
ƒ
„
…
(2)写出A中反应的化学方程式 ,此反应中氧化剂是 ,被氧化的元素是 ;
(3)B瓶中盛饱和食盐水的目的是 ;
(4)C瓶中盛浓硫酸的作用是 ,利用浓硫酸的 性。
(5)若在D瓶中放有湿润的淀粉KI试纸,现象是 ,反应方程式为
。
五、计算题(7分)
32、用含FeS275%的硫铁矿制取硫酸,若反应过程中损失5%的硫,求制取1000kg98%的浓硫酸需这种硫铁矿多少kg。(要求写出所有反应的化学方程式)
【答案】
一、选择题(20分,每小题2分)
1、B 2、A 3、B 4、C 5、D 6、A
7、B 8、D 9、B 10、B
二、选择题(32分,每小题2分)
若该小题有2个答案,选对一个给1分;选对一个,选错一个不给分
11、B 12、BD 13、AC 14、AB 15、AC
16、D 17、D 18、B 19、D 20、B
21、C 22、A 23、D 24、A 25、D
26、D
三、填空题(28分)
27、(6分,每空2分)
12mol/L,25mL,22.5mL
28、(8分,每空1分)
(1)OH-,酚酞 (2)![]() ,稀硝酸
,稀硝酸
(3)![]() ,Ba(NO3)2溶液 (4)Cl-,AgNO3溶液
,Ba(NO3)2溶液 (4)Cl-,AgNO3溶液
29、(3分)
(1)(2分)![]()
(2)(2分)1、14、2、2、3、7、
30、(10分,每空2分,每个离子方程式1分)
甲:HI 乙:Ba(NO3)2 A:S C:BaSO4 E:AgI
(1)![]()
(2)![]()
(3)![]()
四、实验题(13分)
31、(1)(5分,各1分)
长颈漏斗改为分液漏斗 ‚A中烧瓶下应加石棉网
ƒA中应用酒精灯加热 „烧瓶中稀盐酸改浓盐酸
…多余Cl2应用NaOH溶液吸收
(2)(3分,各1分)
![]()
![]()
(3)(1分)吸收Cl2中的HCl
(4)(2分)吸收Cl2中的水蒸气,吸水性
(5)(2分,各1分)试纸由白色变为蓝色,
![]()
五、计算题(7分)
32、方程式略,各1分,关系式及计算过程共4分
![]()
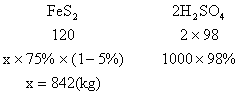
答(略)
