高一化学同步测试(1)—原子结构
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
1.用现代物质结构学说表明原子结构模型的是 ( )
A.道尔顿原子模型 B.卢瑟福原子模型 C.玻尔原子模型 D.电子云模型
2.下列属于同位素的一组是 ( )
A.O2、O3 B.Na2O、Na2O2 C.![]() 、
、![]() D.H、D、T
D.H、D、T
3.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是
A.12 B.14 C.16 D.18
4.我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是( )
的形式存在。下列说法正确的是( )
A.![]() 原子核内含有4个质子 B.
原子核内含有4个质子 B.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子 D.
原子核内含有3个中子 D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
5.下列离子中,所带电荷数与该离子的核外电子层数相等的是 ( ) A.Mg2+ B.Al3+ C.Be2+ D.H+
6.由两种原子组成的纯净物 ( )
A.一定是化合物 B.一定是同素异形体 C.一定是单质 D.可能是单质,可能是化合物
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一至二个选项符合题意,少选扣1分,多选、错选均不给分)
7.对原子核外电子以及电子的运动,下列描述正确的是 ( )
①可以测定某一时刻电子所处的位置 ②电子质量很小且带负电荷
③运动的空间范围很小 ④高速运动 ⑤有固定的运动轨道
⑥电子的质量约为氢离子质量的![]()
A.①②③ B.②③④⑥ C.③④⑤⑥ D.⑤⑥
8.下列粒子属于典型非金属元素的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
9.下列各组粒子中,核外电子总数相等的是 ( )
A.K+和Na+ B.CO2和NO2 C.CO和CO2 D.N2和CO
10.下列叙述正确的是 ( )
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子总数相同的原子,一定是同种元素的原子
D.能与酸反应的氧化物,一定是碱性氧化物
11.某元素的原子核外电子排布中,K电子层和L电子层电子数之和等于M电子层和N电
子层的电子数之和,则该元素的核电荷数为 ( )
A.30 B.12 C.17 D.20
12.在核电荷数为1—20的元素的原子中,次外层电子数为最外层电子数2倍的元素是( )
A.核电荷数为3的元素 B.核电荷数为14的元素
C.核电荷数为6的元素 D.核电荷数为16的元素
13.在与下列原子序数对应的元素的原子中,价电子数最多的是 ( )
A.7 B.13 C.6 D.20
14.下列叙述中,正确的是 ( )
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
15.某元素原子核内质子数为m,中子数为n,则下列论断正确的是 ( )
A.不能由此确定该元素的原子相对质量 B.这种元素的原子相对质量为m+n
C.若碳原子质量为ωg,此原子的质量为(m+n)ωg D.核内中子的总质量小于质子的总质量
16.已知自然界氧的同位素有16O、17O、18O,氢的同位素有 H、D、T,从水分子的原子组成来看,自然界中的水分子一共有 ( )
A.6种 B.9种 C.12种 D.18种
三、填空题(共5小题,计38分)
17.(7分)用符号A:质子数;B:中子数;C:核外电子数;D:最外层电子数;E:电子层数,填写下列各空。
(1)原子种类由________决定。 (2)元素种类由________决定。
(3)相对原子质量由_______决定。 (4)元素的原子半径由_______决定。
(5)元素的化合价主要由____ 决定。(6)元素的化学性质主要由_____决定。
(7)核电荷数由________决定。
18.(6分)下列各题中的物质均由核电荷数为1~10的元素组成。请填写化学式:
(1)只有两个原子核和两个电子组成的分子是__________;
(2)1个最外层有4个电子的原子,和2个最外层有6个电子的原子结合的分子是______;
(3)1个L层有5个电子的原子,和3个只有1个电子的原子结合的分子是_______;
(4)由3个最外层是6个电子的原子结合而形成的分子是________;
(5)由两个原子核10个电子结合成的分子是________,由5个原子核10个电子结合成的分子是________。
19.(8分)A元素原子M电子层上有6个电子。B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子。
(1)B元素的原子结构示意图为________________。
(2)A、B两元素形成的化合物的名称是________,化学式是___________,该化合物在
无色火焰上灼烧时,火焰呈________色。
20.(8分)已知:A.B.C.D四种元素的质子数都小于18,它们的核电荷数A<B<C<D;A与B可生成化合物AB2,每个AB2分子中含有22个电子;C元素原子的次外层电子数为最外层电子数的2倍,D元素原子的最外层电子数比次外层少1个,则各元素符号分别为A________、B____________、C_____________、D____________。
21.(9分)A、B、C、D、E 五种元素,已知:
①A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子M层上的电子比K层多5个。
②常温下B2是气体,它对氢气的相对密度是16。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2.
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激味的气体DB2.D在DB2中的含量为50%.根据以上情况回答:
(1)A是______、B是______、C是______、D是______、E是______(写元素名称);
(2)E的原子结构示意图________,C的离子结构示意图________;
(3)F和AB2反应的化学方程式 。
四、计算题(共2小题,计14分)
22.(6分)某金属重4 g,其原子核外有2 mol 电子,核内共有1.204×1024个中子,该金属与足量盐酸反应,有0.2 mol电子发生转移,生成了6.02×1022个阳离子。
(1)该金属元素符号是____________,摩尔质量是____________。
(2)原子核内有________个质子,________个中子。
23.(8分)有相对原子质量均大于10的A、B二种元素,能形成二种化合物X和Y。已知等物质的量的X和Y混合气的密度是相同条件下H2的18.5倍,其中X和Y的质量比为3∶4.4,经测定X 的组成为AB,Y的组成为A2B,试计算回答:(要计算过程)
(1) A、B二元素的名称:A_______,B_______;
(2) X和Y的分子式:X_______,Y_______。
参考答案
一、选择题
1.B 2.D 3.C 4.B 5.A 6.D
二、选择题
7.B 8.BC 9.D 10.C 11.D 12.AB 13.A 14.A 14.C 15.A 16.D
三、填空题
17.(1)AB (2)A (3)AB (4)AE (5)D (6)D (7)A
18.(1)H2 (2)CO2 (3)NH3 (4)O3 (5)HF,CH4
19.(1)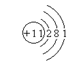 (2)硫化钠;Na2S; 黄
(2)硫化钠;Na2S; 黄
20.C; O; Si; Cl
21.(1)C、O、Na、S、Cl;

(3)2Na2O2+2CO2![]() 2Na2CO3+O2
2Na2CO3+O2
四、计算题
22.(1)Ca; 40g/mol; (2) 20; 20
23.(1)混合气的平均分子量为2×18.5 = 37,各1 mol混合后质量为74 g,由此可得:
MA+MB+2MA+MB=74 ………………………… ①
![]() =
=![]() ………………………………… ②
………………………………… ②
解①、②可得:MB=16,MA=14,即A ─ N,B ─ O
(2)X:NO,Y:N2O