 可能用到的相对原子质量:Si:28
O:16 Ca:40 C:12 K:39 Mg:24 Na:23 S:32 H:1
可能用到的相对原子质量:Si:28
O:16 Ca:40 C:12 K:39 Mg:24 Na:23 S:32 H:1
N:l4
一、单项选择题(每小题只有一个正确选项,每题2分,共36分)
1、相同状况下,等体积的N17O和14CO分子中所含中子总数
A、前者大 B、后者大 C、相等 D、不能确定
2、已知下列反应:Cu+X2==CuX2 2Cu+Y==Cu2Y 2KX+Z2==2KZ+X2 X2、Y、Z2为三种元素的单质。在Cu2Y中,Y为-2价。下列关于X、Y、Z三种元素的最高价氧化物对应的水化物的酸性强弱顺序正确的是
A、HXO4>H2YO4>HZO4 B、HZO4>HXO4>H2YO4
C、HZO4>H2YO4>HXO4 D、H2YO4>HZO4>HXO4
3、由每两种短周期元素X和Y可组成化合物XY3,当X的原子序数为m时,Y的原子序数可能为:①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12,其中正确的组合是
A、只有①②③ B、只有①④⑤⑥ C、只有①③④⑤⑥ D、①②③④⑤⑥
4、A、B、C、D、E是同一周期的五种主族元素。A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A;C和D的最高价氧化物的水化物均呈酸性,且酸性C>D;E是这五种元素中原子半径最小的元素。它们的原子序数由小到大的顺序是
A、ABCDE B、CDABE C、BADCE D、ECDBA
5、在无色透明的强酸性溶液中,能大量共存的是
A、Na+、Al3+、NO3-、Cl- B、Na+、HCO3-、K+、NO3-
C、Fe3+、K+、SO42-、Cl- D、K+、Na+、Cl-、SiO32-
6、在某溶液中滴加用盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中
A、一定含有Ag+ B、一定含有Ag+和SO42-
C、一定含有SO42- D、可能含有Ag+或SO42-
7、下列说法正确的是
A、因为CO2通入水玻璃中可制原硅酸,说明碳酸的酸性比原硅酸的酸性强
B、SiO2既可溶于强碱溶液,又能与氢氟酸反应,故它是两性氧化物
C、因为CaCO3和SiO2固体混合加热时产生CO2气体,说明碳酸的酸性比原硅酸的酸性强
D、因为玻璃中含有SiO2,故玻璃试剂瓶不能盛装碱液
8、有相同质子数的微粒一定是
A、同种元素 B、同种分子 C、同种原子 D、不能确定
9、以下贮存物质的方法正确的是
A、少量白磷贮存在二硫化碳中 B、水玻璃贮存在带玻璃塞的玻璃瓶中
C、少量钠贮存在酒精中 D、少量钠贮存在煤油中
10、下列各组物质,不属于同素异形体的是
A、金刚石和C60 B、晶体硅和无定形硅
C、氧气和臭氧 D、H4SiO4和H2SiO3
11、某元素X所形成的分子X2共有三种,其相对分子质量依次为158、160、162;其三种分子的物质的量之比是7∶10∶7。则下列结论正确的是
A、X有三种同位素
B、其中一种同位素的原子质量数为80
C、质量数为79的同位素其原子的百分含量为50%
D、X2的平均相对分子质量为159
12、下列关于硫酸盐的叙述中正确的是
①水泥厂用石膏来调节水泥硬化的时间;②胆矾、绿矾、皓矾都是带结晶水的硫酸盐;③医疗上用作“钡餐”的BaSO4不能使X射线透过;④硫酸铵是化肥,硫酸钾也能做化肥。
A.只有①②③ B.只有②③④ C.只有②③ D.①②③④
13、将24g石英和80g石灰石在高温下充分反应,反应后放出的气体在标准状况时的体积是
A、4.48L B、8.96L C、11.2L D、17.92L
14、熔融烧碱应选用
A、生铁坩埚 B、石英坩埚 C、陶瓷坩埚 D、玻璃坩埚
15、由10g含杂质的CaCO3与足量的盐酸反应,产生了0.1molCO2,则该杂质可能是
A、MgCO3和SiO2 B、K2CO3和SiO2 C、MgCO3和KHCO3 D、无法确定
16、由CO2和CO组成的混合气体中,经分析测知含氧质量为70%,则该混合气体中CO和CO2的体积比为
A、1∶3 B、7∶33 C、33∶7 D、3∶1
17、关于锗及其化合物的性质的叙述中,错误的是
A、GeO2不溶于NaOH溶液 B、单质锗具有导电性
C、锗能够跟Cl2反应生成GeCl4 D、GeO不稳定,易被氧化
18、只用一种试剂就能鉴别Na2S、Na2SO3、Na2CO3、Na2SO4的是
A、BaCl2溶液 B、盐酸 C、品红溶液 D、NH4Cl溶液
二、多选题:(每个小题有1~2个正确答案,每题2分,共16分)
19、下列各组物质的主要成分都含有硅酸盐的是
A、石英玻璃和水玻璃 B、普通玻璃和钢化玻璃
C、瓷器和陶器 D、普通玻璃和高温结构陶瓷
20、固体熔化时,必须破坏非极性共价键的是
A、冰 B、金刚石 C、干冰 D、氯化钠
21、元素X、Y、Z均位于短周期,且原子序数依次增大。X原子核内只有1个质子;Y原子最外层电子数是次外层电子数的3倍;Z原子最外层电子数比Y原子最外层电子数少。X、Y、Z中的二者或三者形成的化合物不可能是
A、Z2Y5 B、XZY4 C、ZY2 D、X3ZY4
22、下列反应既表现浓硫酸的酸性,又表现其氧化性的是
A、C + H2SO4(浓)→CO2 + SO2↑+ H2O
B、Cu+H2SO4(浓)→CuSO4 + SO2↑+ H2O
C、FeO + H2SO4(浓)→Fe2(SO4)3 + SO2↑+ H2O
D、Na2CO3 + H2SO4(浓)→ Na2SO4 + CO2↑+ H2O
23、常温向一密闭容器中通入SO2和H2S气体共1mol,充分反应后,容器内的压强是反应前容器内压强的1/4(不考虑气体在生成水中的溶解),则SO2和H2S的物质的量之比可能为
A、1∶1 B、1∶2 C、1∶3 D、3∶1
 24、下列关于Cl2和SO2两种气体的说法中,正确的是
24、下列关于Cl2和SO2两种气体的说法中,正确的是
A、在通常状况下,SO2比Cl2易溶于水
B、SO2和Cl2都是强氧化剂
C、SO2和Cl2的漂白原理相同
D、SO2和Cl2溶于水后都形成稳定的酸
25、把CO2通入NaOH溶液中,当CO2与NaOH完全反应时,其质量比为11∶15,则下列说法正确的是
A、溶液中除OH-离子外,只存在一种阴离子 B、溶液中溶质的物质的量之比为1∶1
C、反应物有剩余 D、溶液还可以吸收CO2
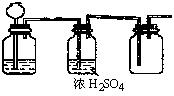 26、根据实验室制取某种干燥气体的装置图(右图),判断气体发生装置中的固体药品和液体可能是
26、根据实验室制取某种干燥气体的装置图(右图),判断气体发生装置中的固体药品和液体可能是
A、FeS和稀H2SO4
B、Na2SO3固体和浓H2SO4
C、大理石和稀HCl
D、MnO2和浓HCl
三、填空题(共27分)
27、正常雨水的pH约为______,当雨水中溶有______等气体时,雨水的pH______,称为______。
28、36g水和18g重水(D2O),含有氧原子个数比 ;含中子个数比为 ;它们与足量金属钠反应,在同温同压下生成氢气的质量比为 。
29、主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的价电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:
(1)写出元素符号A____,B____,C____,D____。
(2)写出B与C在高温下完全反应后生成物的化学式________,电子式_____,它是由____性键(极性、非极性)结合的__________性分子,分子具有______空间结构。
(3)写出B、D在高温下形成的化合物的电子式_________,判断其中的化学键的类型________。
(4)写出一种有A、B、C、D组成的化合物的化学式_________。
30、下图是实验室制取SO2并验证SO2某些性质的装置图。

试回答:
⑴①中的实验现象为: ,此实验证明SO2是 氧化物;
⑵②中的品红试液 ,证明SO2有 性;
⑶③中的实验现象为 ,发生反应的化学方程式是 ;证明SO2有 性;
⑷.④的作用是
 答题纸
答题纸
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | ||||||||||
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | ||||
| 答案 |
将一、二题的答案填入下表中:
三、填空题
27、 、 、 、 。
28、 、 、 。
29、(1)A 、B 、C 、D
(2) 、 、 、 、 。
(3) 、 。
(4)
30、(1) 、 。
(2) 、 。
(3) 、 、
。
(4) 。
31、除去下列物质中的杂质。根据要求填空:(每空1分)
| 物质 | 杂质 | 选用试剂 | 离子方程式 |
| Na2SO4 | NaHSO4 | ||
| CaCO3 | SiO2 | ||
| NaCl | MgCl2 | ||
| CO2 | CO |
32、检验某溶液中是否存在下列离子:SO32-、SO42-、CO32-、S2-、Cl-、Br-、I-,根据下列事实分别做出适当结论。(共6分)
(1)若溶液呈强酸性,不能大量存在的离子是 。
(2)先加盐酸酸化,再加BaCl2溶液,无沉淀产生,则不存在的离子是 。
(3)加入氯水后溶液仍为无色透明,不存在的离子是 。
三、计算题(共7分)
33、4.76g硫酸钠、亚硫酸钠、亚硫酸氢钠的混合物和足量的硫酸作用逸出气体672mL(标准状况),同样质量的混合物恰好和24.04mL3.2%的氢氧化钠溶液(密度为1.04g/mL)反应,试计算在混合物中亚硫酸钠的质量分数.
 答题纸
答题纸
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | D | C | A | D | A | D | D | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | D | D | A | A | A | A | B | BC | B |
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | ||||
| 答案 | B | BC | AC | A | BD | BC |
将一、二题的答案填入下表中:
三、填空题
27、 5.6 、 SO2和NOX 、 <5.6 、 酸雨 。
28、 20∶9 、 16∶9 、 10∶9 。
29、(1)A H 、B O 、C C 、D Na
(2) CO2 、 、 极性 、 非极性 、 直线性 。
(3) 、 离子键和非极性键 。
(4) NaHCO3
30、(1) 变红 、 酸性 。
(2) 褪色 、 漂白 。
(3) 棕红(黄)色褪色 、 SO2+I2+2H2O=H2SO4+2HI 、
还原 。
(4) 吸收多余的二氧化硫 。
31、除去下列物质中的杂质。根据要求填空:(每空1分)
| 物质 | 杂质 | 选用试剂 | 离子方程式 |
| Na2SO4 | NaHSO4 | NaOH | OH—+H+=H2O |
| CaCO3 | SiO2 | NaOH溶液 | SiO2+2OH—=SiO32—+H2O |
| NaCl | MgCl2 | NaOH溶液 | Mg2++OH—=Mg(OH)2 |
| CO2 | CO | CuO |
32、检验某溶液中是否存在下列离子:SO32-、SO42-、CO32-、S2-、Cl-、Br-、I-,根据下列事实分别做出适当结论。(共6分)
(1)若溶液呈强酸性,不能大量存在的离子是 SO32-、CO32-、S2-、 。
(2)先加盐酸酸化,再加BaCl2溶液,无沉淀产生,则不存在的离子是 SO42-、 。
(3)加入氯水后溶液仍为无色透明,不存在的离子是 S2-、 Br-、I-, 。
三、计算题(共7分)
33、4.76g硫酸钠、亚硫酸钠、亚硫酸氢钠的混合物和足量的硫酸作用逸出气体672mL(标准状况),同样质量的混合物恰好和24.04mL3.2%的氢氧化钠溶液(密度为1.04g/mL)反应,试计算在混合物中亚硫酸钠的质量分数.(26.5%)