高一化学1-4章综合练习
姓名 班级
相对原子质量:Na-- 23 Cl-- 35.5 Ag-- 108 N –14 I-- 127
一、选择题(每小题只有一个选项符合题意,共60分)
1、展望21世纪,许多科学家都认为新材料是高技术的突破口,只有更好地开发和应用具有特殊性能的新材料,才能拥有更强大的经济优势和技术潜力。对于新材料的开发和研制,最具有独特优势的学科是( )
A. 物理 B. 化学 C. 地理 D. 生物
2、下列物质的用途,利用了该物质氧化性的是 ( )
A. 用过氧化钠漂白织物 B. 医药上可用小苏打治疗胃酸过多
C. 用钠冶炼钛等金属 D. 用Na—K合金作原子反应堆的导热剂
3、在下列状态下,能导电的电解质是 ( )
A. 氨水 B. 液态氯化氢 C. 液态水银 D. 熔融氯化钠
4、下列粒子只能做还原剂的是 ( )
A. Cu2+ B. Fe2+ C. SO2 D. Cl-
5、下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
A. Na2O2与CO2 B. Na与O2 C. NaOH与CO2 D. C与O2
6、称烧碱时,不将它放在纸上,而放置在烧杯等玻璃器皿中,主要原因是( )
A. 纸上称量易沾上杂质,降低所配溶液的纯度
B. 配制溶液总是在烧杯中进行的,直接在烧杯中进行称量的目的是为了减少操作步骤
C. 放纸上称量没有置烧杯中称量准确
D. 烧碱易潮解,且腐蚀性强
7、不能用Ca2++CO2-3 = CaCO3↓ 表示离子反应的是 ( )
A. CO2通入澄清的石灰水中 B. 氯化钙溶液中加入碳酸钾溶液
C. 澄清的石灰水与纯碱溶液混合 D. 碳酸铵溶液中加入硝酸钙溶液
8、下列各组离子在碱性溶液中能够大量共存的是( )
A. Na+ Ag+ Cl- SO2-4 B. Mg2+ Al3+ Cl- SO2-4
C. K+ Na+ Cl— CO2-3 D. NH+4 H+ ClO- NO-3
9、下列五种物质在空气中长期放置,能得到同一种固体物质的是( )
① Na2O2 ② Na ③ NaOH ④ Na2CO3·10H2O ⑤ Na2O
A. 只有②③⑤ B. 除④外都可以 C. ①②③ D. 全部可以
10、中国科学院北京真空物理实验室研究人员于1993年年底以超真空扫描隧道显微镜(STM)为手段,得到用硅原子组成的两个汉字——中国,教材中图示的是经放大180万倍在计算机屏幕上显示出来的,这两个字的“笔画”宽度约2 nm。据此可估计,硅原子的实际直径大小约为
A. 10—6 m B. 10—8 m C. 10—10 m D. 10—12 m
11、泡沫灭火器内装的药液之一是NaHCO3饱和溶液,而不选用更廉价的Na2CO3饱和溶液。其原因是 ( )
① 质量相同的两种钠盐,NaHCO3与足量酸反应产生CO2气体多
② 产生相同质量的CO2,消耗的酸量NaHCO3比Na2CO3少
③ NaHCO3与酸的反应比Na2CO3快得多
④ NaHCO3比Na2CO3稳定,便于长期保存
A. ①②③④ B. ①②③ C. 只有①② D.只有②③
12、将一小块钠投入以下物质中,能产生气体和沉淀的是 ( )
A. MgCl2溶液 B. 水 C. BaCl2溶液 D. 稀H2SO4
13、下列说法正确的是 ( )
A. 氧化还原反应中一定有电子的得失或电子对的偏移
B. 离子化合物一定是电解质,共价化合物一定是非电解质
C. 强电解质溶液的导电能力一定比弱电解质溶液强
D. 在化学反应中,反应物的总能量一定等于生成物的总能量
14、下列离子方程式书写正确的是 ( )
A. 铝片溶于盐酸中 Al+2 H+ =Al3++H2↑
B. 金属钾投入水中 2 K + 2 H2O =2K + + 2 OH — + H2↑
C. CO2 通入CaCl2 溶液中 CO2+Ca2++H2O=CaCO3↓+2H+
D. 将稀硝酸加入BaCO3中 CO32— +2 H + = CO2↑+ H2O
 15、已知氧化物有普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三种均能与水或CO2反应产生O2。如右图所示,现已用平底烧瓶收集得到CO2 ,在瓶内有一只扎紧在玻璃管末端的气球,打开塞子迅速往瓶里加入下列某物质,并立即塞紧塞子,一段时间后,气球就会自动膨胀起来。则该物质是
15、已知氧化物有普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三种均能与水或CO2反应产生O2。如右图所示,现已用平底烧瓶收集得到CO2 ,在瓶内有一只扎紧在玻璃管末端的气球,打开塞子迅速往瓶里加入下列某物质,并立即塞紧塞子,一段时间后,气球就会自动膨胀起来。则该物质是
A. Na2CO3 B. Na2O2 C. KO2 D. RbO3
16、将碘和食盐分离开的最好的方法是( )
A.升华 B.筛选 C.结晶 D.过滤
17、向溴化钠、碘化钠的混合溶液中通入足量氯气之后加热,将溶液蒸干,并灼烧片刻,最后残留的物质是( )
A.NaCl B.NaCl、NaBr、NaI C.NaBr、NaI D.NaCl、I2
18、溴化碘(IBr)的化学性质类似卤素单质,它同水反应的化学方程式为
IBr + H2O = HBr + HIO
下列有关IBr的叙述不正确的是( )
A、IBr是共价合物 B、在化学反应中,IBr可做氧化剂
C、IBr跟水反应时既不是氧化剂也不是还原剂
D、IBr跟NaOH稀溶液反应生成NaI、NaBrO和水
19、将4.6g Na 投入足量的水中得到200mL 溶液,该溶液的物质的量浓度是( )
A、0.1 mol/L B、0.2 mol/L C、1 mol/L D、2 mol/L
20、在反应8NH3 + 3Cl2== 6NH4Cl + N2中, 若有2molNH3被氧化,则( )
A、生成1molN2 B、有4molNH3 参加反应
C、3 mol氯原子被还原 D、3molCl2被氧化
二、填空题(每空2分,共30分)
21、3 mol![]() 离子恰好将2mol
离子恰好将2mol![]() 离子还原,则X元素在还原产物中的化合价为
。
离子还原,则X元素在还原产物中的化合价为
。
22、在![]() 中,
中,![]() 为 。
为 。
23、已知铜在常温下能被稀HNO3溶解:3Cu + 8 HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)请将上述反应改写成离子方程式(并标明电子转移方向和数目):
(2)上述反应中,HNO3没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比是 。
24、现有下列3个氧化还原反应:
2 FeCl3 + 2 KI = 2 FeCl2 + 2 KCl + I2 2 FeCl2 + Cl2 = 2 FeCl3
2 KMnO4 + 16 HCl = 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
(1)若某溶液中有Fe2+、I — 和Cl — 共存,要除去I — 而不影响其他离子的存在,可加入上述反应物中的试剂是 。
(2)在强酸性溶液中,将MnO4—、Fe2+、Fe3+、I — 四种离子的溶液混在一起,充分反应后:
① 若溶液中有I — 剩余,则溶液中一定无 。
② 若溶液中有MnO4— 剩余,则溶液中一定无 。
25、将质量为m1的NaHCO3固体加热分解一段时间后,测得剩余固体的质量为m2 。
(1)生成的Na2CO3的质量为 。
(2)当剩余固体的质量为 时,可以判定NaHCO3已完全分解。
26、翰林汇现用MnO2与浓盐酸反应制氯气,再用铜粉和氯气制取少量CuCl2 ,其实验流程示意图如下:
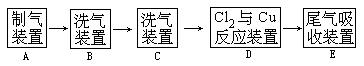
上图中“→”表示气流方向。请完成下列填空。
(1)A 中发生反应的化学方程式为 ;
(2)C中选用的试剂是 。
(3)D中的化学方程式为 。
(4)若E中的试剂只能从下列物质中选择:KOH溶液、纯水、KMnO4溶液、稀盐酸、浓硫酸,饱和石灰水,你认为应选择的试剂是 ,吸收反应的离子方程式是
。
三、计算题(共10分)
现有含碘化钠30g 的溶液100g ,将它平分为两份。
1、(4分)往一份中加入100g 17 % 的硝酸银溶液,可得到沉淀多少?
2、(6分)往另外一份中通入一定量氯气后,将溶液蒸干并灼烧,得到固体7.68 g ,试通过计算确定7.68 g固体的组成。