高一(上)化学单元同步练习及期末试题
第一章 化学反应及其能量变化
第一节 氧化还原反应
Ⅰ.学习重点:
1.在复习四种基本反应类型和从得氧、失氧角度划分氧化反应和还原反应的基础上能从化合价升降和电子转移的角度来理解氧化还原反应,了解氧化剂、还原剂的概念。
2.会分析判断某反应是否是氧化还原反应,判断氧化剂和还原剂,并会用“双线桥”表示电子转移的方向和数目。
Ⅱ.学习难点:
用“双线桥”法分析氧化还原反应,判断氧化剂和还原剂。
Ⅲ.训练练习题:
一、选择题:
1.有关氧化还原反应的叙述正确的是( )
A.氧化还原反应的实质是有氧元素的得失
B.氧化还原反应的实质是元素化合价的升降
C.氧化还原反应的实质是电子的转移(得失或偏移)
D.物质所含元素化合价升高的反应是还原反应
2.下列化学反应基本类型中一定是氧化还原反就的是( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
3.下列哪一个反应表示二氧化硫被还原( )
A.SO2+2H2O+Cl2![]() H2SO4+2HCl B.SO2+H2S
H2SO4+2HCl B.SO2+H2S![]() 2H2O+3S
2H2O+3S
C.SO2+2NaOH![]() Na2SO3+H2O D.SO2+Na2CO3
Na2SO3+H2O D.SO2+Na2CO3![]() Na2SO3+CO2↑
Na2SO3+CO2↑
4.下列化学方程式中电子转移不正确的是( )
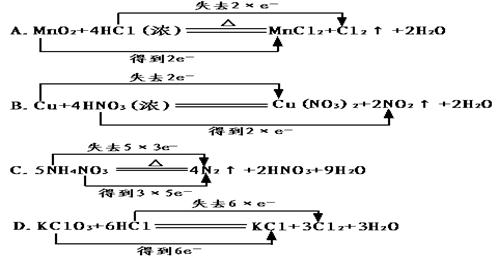
5.某元素在化学反应中由化合态变为游离态,则该元素( )
A.一定被氧化 B.一定被还原
C.既可能被氧化又可能被还原 D.以上都不是
6.下列反应盐酸作还原剂的是( )
A.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B.CaCO3+2HCl![]() CaCl2+CO2↑+H2O
CaCl2+CO2↑+H2O
C.2HCl+Zn![]() ZnCl2+H2↑
ZnCl2+H2↑
D.2KMnO4+16HCl![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
7.在Fe2O3+3CO![]() 2Fe+2CO2反应中,Fe2O3( )
2Fe+2CO2反应中,Fe2O3( )
A.在被氧化 B.是氧化剂 C.被还原 D.是还原剂
8.下列变化需要加入还原剂才能实现的是( )
A.Na2SO3![]() SO2
B.HCl
SO2
B.HCl![]() Cl2
Cl2
C.H2SO4(浓) ![]() SO2
D.SO2
SO2
D.SO2![]() S
S
9.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
A.CO2+H2O![]() H2CO3
H2CO3
B.2Na2O2+2H2O![]() 4NaOH+O2↑
4NaOH+O2↑
C.3Fe+4H2O(g)
![]() Fe2O4+4H2
Fe2O4+4H2
D.2Na+2H2O![]() 2NaOH+H2↑
2NaOH+H2↑
10.在3Cl2+6KOH![]() 5KCl+KClO3+3H2O反应中,还原产物是( )
5KCl+KClO3+3H2O反应中,还原产物是( )
A.KClO3 B.KCl C.KCl+H2O D.H2O
11.在5KCl+KClO3+3H2SO4![]() 3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为( )
3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为( )
A.1:1 B.5:1 C.1:5 D.3:1
12.盐酸能发生下列反应:
①
Zn+2HCl![]() ZnCl2+H2↑
ZnCl2+H2↑
②
2HCl+CuO![]() CuCl2+H2O
CuCl2+H2O
③
MnO2+4HCl![]() MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
因此盐酸应当具有的性质是( )
A.只有酸性 B.只有氧化性
C.只有还原性 D.有酸性、有氧化性和还原性
13.下面三个方法都可以用来制氯气:
4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
4HCl(g)+O2![]() 2Cl2+2H2O(g)2
2Cl2+2H2O(g)2
则三种氧化剂由强到弱的顺序是( )
A.O2 MnO2 KMnO4 B.KMnO4 MnO2 O2
C.MnO2 KMnO4 O2 D.O2 KMnO4 MnO2
14.已知M2O7x-+3S2-+14H+![]() 2M3++3S↓+7H2O,则M2O7x-中的M的化合价为( )
2M3++3S↓+7H2O,则M2O7x-中的M的化合价为( )
A.+2 B.+3 C.+4 D.+6
15.11P+15CuSO4+24H2O![]() 5Cu3P+6H3PO4+15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是( )
5Cu3P+6H3PO4+15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是( )
A.6:5 B.5:6 C.11:5 D.11:6
16.对于反应CaH2+2H2O![]() Ca(OH)2+2H2↑有下列判断:①H2只是氧化产物,②H2只是还原产物,③H2O是氧化剂,④CaH2中的H元素被还原,⑤此反应中的氧化产物和还原产物的分子个数之比为1:1。上述判断正确的是( )
Ca(OH)2+2H2↑有下列判断:①H2只是氧化产物,②H2只是还原产物,③H2O是氧化剂,④CaH2中的H元素被还原,⑤此反应中的氧化产物和还原产物的分子个数之比为1:1。上述判断正确的是( )
A.①④⑤ B.②④ C.① D.③⑤
17.根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O![]() H2SO4+2HI
H2SO4+2HI
2FeCl2+Cl2![]() 2FeCl3
2FeCl3
2FeCl2+2HI![]() 2FeCl3+2HCl+I2
2FeCl3+2HCl+I2
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
18.G、W、X、Y、Z均为含氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G![]() W+NaCl
②W+H2O
W+NaCl
②W+H2O![]() X+H2 ③Y+NaOH
X+H2 ③Y+NaOH![]() G+W+H2O
G+W+H2O
④Z+NaOH![]() W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是( )
W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是( )
A.W、G、Z、Y、X B.G、Y、W、Z、X
C.G、Y、Z、W、X D.Z、X、G、Y、W
19.同一物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
A.Cl2+H2O![]() HCl+HClO
HCl+HClO
B.NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
C.3N02+H2O![]() 2HNO3+NO
2HNO3+NO
D.SO2+2H2S![]() 2H2O+3S
2H2O+3S
20.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O![]() NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价)( )
NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价)( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1:1
二、填空题
21.下列微粒:Fe、Cl-、H+、F2,其中能得到电子的微粒有 ,该元素的化合价 ,表现出 性,是 剂,具有还原性的微粒是 ,它们在反应中 (填得或失)电子,发生 反应(填氧化或还原),其化合价 。
22.请把符合要求的化学反应方程式的编号填入括号内:
(1)是分解反应又是氧化还原反应的是( )
(2)是分解反应不是氧化还原反应的是( )
(3)是化合反应又是氧化还原反应的是( )
(4)是化合反应不是氧化还原反应的是( )
(5)不属于四种基本反应类型的氧化还原反应的是( )
A.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
B.2Fe+3Cl2![]() 2FeCl3
2FeCl3
C.NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
D.CaO+CO2![]() CaCO3
CaCO3
E.Cl2+H2O![]() HCl+HClO
HCl+HClO
23.反应2KMnO4+16HCl![]() 2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是
,还原剂是
,若生成71gCl2,被氧化的HCl是
g。
2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是
,还原剂是
,若生成71gCl2,被氧化的HCl是
g。
24.在下列反应中,氨做氧化剂的是 ,氨做还原剂的是 。
A.3Cl2+8NH3![]() 6NH4Cl+N2
6NH4Cl+N2
B.2NH3+H2SO4![]() (NH4)2SO4
(NH4)2SO4
C.2NH3+2Na![]() 2NaNH2+H2
2NaNH2+H2
D.NH3+NaH![]() NaNH2+H2
NaNH2+H2
三、简答题
25.在下列化学方程式中,标出电子转移的方向和数目,指出氧化剂和还原剂,氧化产物和还原产物
(1)3S+6KOH![]() K2SO3+K2S+3H2O
K2SO3+K2S+3H2O
(2)S+2KNO3+3C![]() K2S+N2+3CO2
K2S+N2+3CO2
(3)3Cu+8HNO3![]() 3Cu(NO3)2+2NO+4H2O
3Cu(NO3)2+2NO+4H2O
(4)4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
四、计算题
26.取含MnO2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2密度为3.17g/L)计算:
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
27.在3BrF3+5H2O![]() 9HF+HBrO3+O2↑+Br2反应中,若有5.4gH2O被氧化,求被水还原的BrF3是多少g?
9HF+HBrO3+O2↑+Br2反应中,若有5.4gH2O被氧化,求被水还原的BrF3是多少g?
参 考 答 案
一、1.C 2.D 3.B 4.D 5.C 6.AD 7.BC 8.CD 9.B 10.B 11.B 12.D 13.B 14.D 15.A 16.D 17.D 18.B 19.AC 20.BD
二、21.H+、F2,降低,氧化性,氧化,Fe、Cl-,失去,氧化,升高 22.(1)A(2)C(3)B(4)D(5)E 23.KMnO4,HCl,73 24.CD,A
三、25.略
四、26.(1)78.1% (2)18.25g 27.27.4g