江苏六合高级中学第一学期高一化学期中试卷
可能用到的相对原子质量:
H—1; Li—7; C—12; N—14; O—16; Na—23; K—39
请将所有选择题题目的答案一律填写在答题栏中!!!
一、选择题(本题5小题,每小题2分,共10分;每小题只有一个正确答案)
1、下列变化不属于氧化还原反应的是 ( )
A、铁生锈 B、炉子生火 C、煤燃烧 D、石灰水变浑
2、钠元素在自然界中存在的主要形式是( )
A、单质 B、氧化物 C、氯化物 D、氢氧化钠
3、下列物质中可用于治疗胃酸过多的物质是 ( )
A、NaOH B、NaCl C、NaHSO4 D、NaHCO3
4、某元素在化学反应中由化合态变为游离态,则该元素 ( )
A、一定被氧化 B、既可能被氧化,又可能被还原
C、一定被还原 C、既不可能被氧化,又不可能被还原
5、焰色反应是 ( )
A、元素的性质 B、单质的性质
C、离子的性质 D、化合物的性质
二、选择题(本题15小题,每小题3分,共45分;每小题有一个或两个选项符合题意,多选、选错不得分,少选得1分,全选对的得3分)
6、在离子方程式中必须用离子符号表示的物质是 ( )
A、强电解质 B、弱电解质 C、能电离出离子的物质 D、可溶的强电解质
7、关于钠离子的叙述正确的是( )
A、要保存在煤油里 B、化学性质活泼,遇水放出氢气
C、具有很强的还原性 D、在无色的火焰上灼烧,火焰呈黄色
8、Na2O和Na2O2的下列叙述中正确的是 ( )
A、Na2O比Na2O2稳定 B、均可与水反应
C、均可与CO2反应 D、均是典型的碱性氧化物
9、下列关于氧化还原反应的叙述正确的是 ( )
A、金属单质在反应中只作为还原剂
B、非金属单质在反应中只作为氧化剂
C、金属原子在反应中失去电子越多,其还原性越强
D、氢气与氧化铜的反应只属于还原反应
10、可以用H++OH-=H2O表示的离子反应是( )
A、碳酸氢钠溶液和烧碱溶液反应 B、醋酸和氢氧化钾溶液反应 C、硫酸氢钠溶液与苛性钾溶液反应 D、稀硫酸和氢氧化钡溶液反应
11、某物质的水溶液可导电,但其属于非电解质,该物质可能是 ( )
A、氯化氢 B、二氧化碳 C、氧化钠 D、乙醇
12、向紫色石蕊试液中加入过量Na2O2粉末,振荡,下列叙述中正确的是( )
A、溶液仍为紫色 B、最后溶液变蓝色
C、最后溶液褪色 D、有气泡产生
13、根据下列反应,推断盐酸应当具有的性质是( )
![]() ①Zn+2HCl=ZnCl2+H2↑; ②2HCl+CuO=CuCl2+H2O;
①Zn+2HCl=ZnCl2+H2↑; ②2HCl+CuO=CuCl2+H2O;
③MnO2+4HCl MnCl2+Cl2↑+H2O
A、只有酸性 B、只有氧化性
C、只有还原性 D、有酸性、有氧化性和还原性
14、下列各离子组中,在同一无色溶液中能大量共存的是( )
A、 H+ 、Cl-、Na+、CO32- B、 Na+、OH-、K+、HCO3-
C、 OH-、K+、Cl-、Na+ D、 Cu2+、Na+、Cl-、NO3-
15、关于铷的叙述中不正确的是( )
A、它的原子核外最外层上只有一个电子 B、铷投入水中会引起爆炸
C、铷的还原性比钠的还原性弱 D、氢氧化铷是一种强碱
16、泡沫灭火器内装的药液之一是NaHCO3饱和溶液而不选用更廉价的Na2CO3饱和溶液,其原因是:①质量相同的两种钠盐,NaHCO3与足量酸反应产生的CO2比Na2CO3多;②产生同质量的CO2,消耗NaHCO3的质量比Na2CO3少;③NaHCO3与酸的反应比Na2CO3快得多;④NaHCO3比Na2CO3稳定,便于长期保存( )
A、只有①③ B、只有②③ C、①②③ D、①②③④
17、将4.6g钠投入到95.4g水中,所得溶液中溶质的质量分数为( )
A、等于4.6% B、等于8.0% C、小于8.0% D、大于8.0%
18、某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的饱和NaHCO3溶液和灼热CuO,气体体积都没有变化,再通过足量的Na2O2固体,气体体积减小,最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体,以下对混合气体组成的判断正确的是( )
A、一定没有N2,CO和HCl中至少有一种
B、一定有N2、HCl和CO
C、一定有N2,CO和HCl中至少有一种
D、一定有N2和HCl,没有CO
19、若M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为 ( ) A、+2 B、+3 C、+4 D、+6
20、被称为万能还原剂NaBH4溶于水并和水反应:NaBH4+2H2O ==NaBO2+4H2↑
下列说法中正确的是(NaBH4中H元素为-1价) ( )
A、NaBH4既是氧化剂又是还原剂 B、NaBH4是还原剂,H2O是氧化剂
C、硼元素被氧化,氢元素被还原 D、被氧化的元素与被还原的元素质量比为1:1
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填空题(共15分)
21、(2分)从离子反应的角度来看,复分解反应的实质是 ,这类反应发生的条件是有 或 或 生成,具备上述条件之一,反应既可发生。
22、(6分)刚切开的钠的断面呈______色,有______光泽,钠断面在空气中会变___,原因是:___________ ________,反应的化学方程式____ __________;将所得的氧化物放入水中,写出反应的化学方程式 。
23、(2分)在宇宙飞船中,为了使宇航员得到良好的生存环境,一般在飞船机内安装了盛有Na2O2颗粒的装置,它的用途是再生O2,如果用KO2代替Na2O2也能达到同样的目的,反应产物也很相似。
(1)写出KO2与CO2反应的化学方程式 ;
![]() (2)计算用Na2O2和KO2分别与CO2反应,产生等量的氧气,所需Na2O2和KO2质量比为1: (精确到小数点后的一位小数)。
(2)计算用Na2O2和KO2分别与CO2反应,产生等量的氧气,所需Na2O2和KO2质量比为1: (精确到小数点后的一位小数)。
24、(3分)在反应 中,氧化剂是 ,还原剂是 ,电子转移的数目为 。
25、(2分)用M表示任意一种碱金属元素,则碱金属与H2O反应的化学方程式可表示为______________________ __;若要从足量水中置换出等质量的氢气,需要Li、Na、K的质量比是_____________。
四、推断题(共9分)
26、(3分)有一包白色粉末是由Na2SO4、K2CO3、KNO3、BaCl2中的两种化合物组成,其焰色反应为紫色(透过蓝色钴玻璃);当加水配成溶液时,有沉淀生成。此白色粉末由 和 组成,生成沉淀反应的化学方程式为 。
27、(6分)有一白色固体A,分为等质量的甲、乙两份,甲份加热发生分解得到残余物C,同时产生能使澄清石灰水变混浊的气体B,乙份加足量盐酸,也产生气体B,但产生气体的量是甲份的两倍,气体B跟淡黄色固体粉末D反应产生无色无味气体E,同时得到C,另取少量粉状A,进行焰色反应,火焰呈黄色。
(1)写出A——E的化学式:
A__________ B___________ C__________ D________ E__________
(2)写出A与盐酸反应的离子方程式:
______________________________________________________
五、实验题(共10分)
28、(6分)除去下列物质中的杂质(括号中的物质为杂质),请填表中空白处:
| 物质 | 加入试剂 | 离子方程式 |
| KCl(K2CO3) | ||
| NaHCO3(Na2CO3)溶液 | ||
| FeSO4 (CuSO4) 溶液 |
29、(4分)如图所示, (Ⅰ)中充满CO2气体,小试管中盛有NaOH溶液,导管下系有一个气球。设法使NaOH溶液倾入瓶中,轻轻振荡,气球渐渐胀起(Ⅱ)。
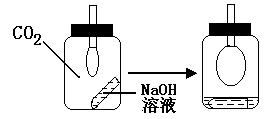 (1)用离子方程式和简要的文字说明
(1)用离子方程式和简要的文字说明
气球胀起的原因:
;
(2) 实验前和实验后分别在天平上称 整个装置的质量,m(Ⅰ) m(Ⅱ)
(填写大于、小于或等于),原因是 。
六、计算题(共11分)
30、(5分) 加热84g NaHCO3到没有气体放出时,剩余的物质是什么?计算剩余物质的质量。
31、(6分) Na2CO3和NaHCO3的混合物共19g,与足量的盐酸反应生成的CO2气体通过足量的Na2O2后,得到3.2g的气体,求混合物中Na2CO3和NaHCO3的质量各为多少?
第一学期高一化学期中试卷答案
—﹠二、选择题(合计55分;1~~~5小题,每小题2分;6~~~15题,每题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | D | B | A | D | D | BC | A | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | CD | D | C | C | C | D | C | C | BD |
三、填空题(共15分)(除21题每空0.5分外其余每小空1分)
21、(2分) 两种电解质在溶液中相互交换离子的反应;
难溶的物质; 难电离的物质; 挥发性的物质
 22、(6分)银白; 金属; 暗; 被空气中的氧气氧化;
22、(6分)银白; 金属; 暗; 被空气中的氧气氧化;
;Na2O + H2O = 2NaOH
23、(2分) (1) 4KO2 + 2CO2 = 2K2CO3 + 3O2 (2) 1:0.6
24、(3分) O2 ;Cu ;4e-
25、(2分) 2M + 2H2O = 2MOH + H2↑;7:23:39
四、推断题(共9分)(每小空1分)
26、(3分) K2CO3;BaCl2;K2CO3 + BaCl2 = BaCO3 ↓+ 2KCl
27、(6分)(1)A:NaHCO3;B:CO2;C:Na2CO3 ;D:Na2O3;E:O2;
(2)HCO3-+H+=H2O + CO2↑
五、实验题(共10分)
| 加入试剂 | 离子方程式 |
| HCl | CO32-+2H+=H2O + CO2↑ |
| CO2 | CO32-+ CO2+H2O = 2 HCO3- |
| Fe | Fe+Cu2+=Fe2++Cu |
28、(6分)
(每小空1分)
29、(4分)(1) CO2+2OH- = CO32-+ H2O(1分),NaOH溶液吸收CO2,使瓶内的压强大大降低,低于外界气压,空气充入气球(1分);
(2)小于(1分);反应前后物质质量守恒,但(Ⅱ)中增加了进入气球的空气的质量(1分)
六、计算题(共11分)
30、(5分) 剩余的物质是:Na2CO3 (2分) ;质量:53g(3分)
31、(6分) Na2CO3:10.6g (3分);NaHCO3:8.4g(3分)