南昌市八一中学高一年级化学竞赛测试题
命题人:江明辉 2005.01.
可用到的相对原子质量:H-1,C-12,N-14,O-16,Na-23,Mg-24, P-31,S-32, Cl-35.5,K-39,Mn-55,Ba-137
一、选择题(共48分,每题3分,每题只有一个答案,答案填在第2面的表格内)
1.2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为中不符合这一主题的是
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.节约能源,提高能源利用率
2.下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子总数相同的原子,一定是同种元素的原子
D.能与酸反应的氧化物,一定是碱性氧化物
3.下列有关溶液性质的叙述,正确的是
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化气体
B.20℃,100 g水可能溶液34.2 g KCl,此时KCl饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.将10.6gNa2CO3固体溶解于1000mL蒸馏水,得到0.1mol·L-1的Na2CO3溶液
4.人在剧烈运动以后,血液中产生较多的乳酸(化学式为C3H6O3),使肌肉酸痛。放松一段时间后,由于乳酸与吸入的氧气反应生成二氧化碳和水,使肌肉的酸痛感消失。表示此反应的化学方程式书写正确的是
A.C3H6O3+O2=CO2+H2O B.C3H6O3+3O2=3CO2+3H2O
C.C3H6O3+3O2=3CO2↑+3H2O D.2C3H6O3+6O2=6CO2+6H2O
5.从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
A.Cu2S既是氧化产物又是还原产物 B.5 mol FeS2发生反应,有10 mol 电子转移
C.FeS2只作还原剂 D.产物中的SO![]() 离子有一部分是氧化产物
离子有一部分是氧化产物
6.下列说法不正确的是
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L
D.32g氧气所含的原子数目为2×6.02×1023
+1 -2 +6 +1
7.有H、O、S、K四种元素,按指定化合价(H、O、S、K)组合,最多可以组成化合物的种数是
A.7种 B.6种 C.5种 D.4种
8.将40mL1.5mol·L-1的CuSO4溶液与30mL3mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,此时溶液中c(Cu2+)和c(OH-)都已变得很小,可忽略。则生成沉淀的组成可表示为
A.Cu(OH)2 B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
| 化合物 | x | y | z |
| 相对分子质量 | 60 | 90 | 96 |
| R% | 40% | 40% | 50% |
9.有x、y、z三种含R元素的化合物,已知下列数据
(其中R%表示R元素在化合物中所占的质量分数),
则R元素的相对原子质量为
A.48 B.24 C.12 D.36
10.取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
A.H2 B.CO C.C6H12O6 D.C12H22O11
11.假定把12C的相对原子质量改为24,以0.024kg12C所含原子数为阿伏加德罗常数,那么下列说法中不正确的是
A.标准状况下,44gCO2的体积仍为22.4L
B.阿伏加德罗常数的近似值仍为6.02×1023/mol C.16O相对原子质量为32
D.常用密度为1.84g/cm3的98%浓硫酸的物质的量浓度为9.2mol/L
12.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.MnO4- B.Fe3+ C.Cl2 D.HNO2
13.某K2CO3样品中含有Na2CO3、KNO3、Ba(NO3)2三种杂质中的一种或两种。现将13.8g样品加入足量水,样品全部溶解。再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质的正确判断是
A.肯定有KNO3、肯定无Na2CO3 B.肯定有KNO3可能还含有Na2CO3
C.肯定没有Ba(NO3)2、可能有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
14.已知35% NaOH溶液的密度为1.38g.cm-3,5% NaOH溶液的密度为1.05 g.cm-3,若将上述两种溶液等体积混合,所得NaOH溶液的质量分数是
A.大于20% B.等于20% C.小于20% D.无法估算
15.下列指定微粒的个数比为2∶1的是
A.BaO2(过氧化钡)固体中的阴离子和阳离子B.![]() 原子中的中子和质子
原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子 D.Be2+离子中的质子和电子
16.现有a、b、c、d四种无色溶液,分别是碳酸钠溶液、硫酸、氯化钡溶液、盐酸中的一种。根据表格中它们两两间相互反应的实验记录,推断a、b、c、d的顺序正确的是
| a | b | c | d | |
| b | 无明显现象 | —— | 有气体生成 | 有沉淀生成 |
| c | 有气体生成 | 有气体生成 | —— | 有沉淀生成 |
A.H2SO4、Na2CO3、BaCl2、HCl B.Na2CO3、H2SO4、HCl、BaCl2
C.HCl、H2SO4、Na2CO3、BaCl2 D.NaOH、Ca(OH)2、Ba(OH)2
二、填空题(共27分)
17.(8分)
⑴ 1摩尔高锰酸钾在240-300oC加热释放出19.2 g 氧气,写出反应方程式。
(已知K2MnO4 640oC分解,K3MnO4 800oC分解。)
⑵ 铀主要以三种同位素的形式存在,三种同位素的原子百分含量分别是![]() 0.005%、
0.005%、![]() 0.72%、
0.72%、![]() 99.275%。请列出计算U元素近似原子量的计算式(不必算出具体数值):
99.275%。请列出计算U元素近似原子量的计算式(不必算出具体数值):
⑶ 将4.74gK2SO4·Al2(SO4)3·nH2O的样品溶于水,配制成250mL溶液,取出20mL与浓度为0.064mol·L-1的氯化钡溶液25mL恰好完全反应生成沉淀。则K+的物质的量浓度为 ,n值为 。
18.(14分)根据下面物质间转换的框图,回答有关问题:
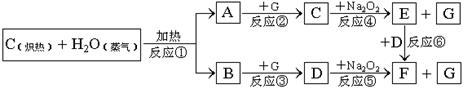
⑴ 由反应①产生的A、B混合物的工业名称是 。
⑵ 写出框图中D、E的化学式:D ;E
⑶ 如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是_ L,同时反应中转移电子总数是 NA。(NA表示阿佛加德罗常数)
⑷ 如果A、B混合气体7.8g(平均摩尔质量10g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重 g,并得到O2 mol。
19.(5分)常温下甲、乙两种气体组成的混合气体(甲的式量小于乙的式量),经分析得知其中只含氮、氢两种元素,而且不论甲乙以何种比例混合,氮和氢的质量比种大于14∶3。由此可知,甲为 ,乙为 ,理由是 。若上述混合气体中氮和氢的质量比为7∶1,则在混合气体中甲和乙的物质的量之比为 ,甲在混合气体中的体积分数为 。
三、实验题(共8分)
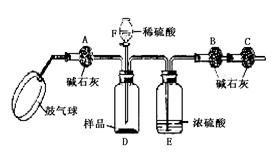 20.某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
20.某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
[实验原理]:Na2CO3+H2SO4=Na2SO4+H2O+CO2 ↑
通过实验测定反应产生的二氧化碳的质量,即可求
得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的
质量分数。
[实验装置]:如图
[实验步骤]:①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。 (称量时注意封闭B的两端。)③按动鼓气球,持续约1分钟。
④连接上B、C。⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)⑧计算。
⑴已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是 ,若去掉该装置测定结果将 (填偏高、偏低或无影响);干燥管C的作用是 ,E装置的作用是 。
⑵步骤③中鼓气的目的是 ;步骤⑥的操作是(填在横线上),其主要目的是 ;本实验不能同时省略③、⑥两个步骤,原因是 。
四、计算题(共17分)
21.(8分)现有等物质的量的NaHCO3和KHCO3的混合物a(g)与100mL盐酸反应.题中涉及的气体体积均为标准状况下,填空时可以用带字母的分式表示.
⑴ 该混合物中NaHCO3与KHCO3的质量比为____________.
⑵ 如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为___________mol·L-1.
⑶ 如盐酸过量,生成CO2的体积为_____________L
⑷ 如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还须知道______________,说明原因: 。
22.(9分)氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中
Ba(OH)2·nH2O的含量。
⑴ 称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
⑵ 另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
⑶ 试样中Ba(OH)2·nH2O的质量分数为 。
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | B | C | A | B | D | C | A | D |
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 | C | D | B | A | B | A | D | C |
![]() 17.(8分)
17.(8分)
⑴5KMnO4 K2MnO4 + K3MnO4 + 3MnO2 + 3O2↑
⑵(234×0.005 + 235×0.72 + 238×99.275)×10-2 ⑶0.04mol/L,24
18.(14分)⑴水煤气;⑵CO2,NaOH;⑶22.4,2;⑷7.8,0.39
19.(5分)NH3;N2;纯净的NH3中,m(N):m(H)=14:3,而混合气体中恒在m(N):m(H)>14:3,因此必为NH3和N2的混合气体,且NH3的式量小于N2;4∶1;80%
20.(8分)
⑴ 除去鼓入的空气中的二氧化碳;偏高;防止空气中的二氧化碳和水进入B中影响实验结果;防止D中的水蒸气进入B中.
⑵ 用除去二氧化碳的空气赶走体系中的二氧化碳;按动鼓气球,持续约1分钟;用除去二氧化碳的空气将反应产生的二氧化碳全部赶入B中;空气中的二氧化碳含量与反应后体系中的二氧化碳含量不同
21.(8分)
⑴ 二者以等物质的量混合,设NaHCO3质量为x g,则
含KHCO3为(a—x)g,则![]() ,x=
,x=![]()
即m(NaHCO3):m(KHCO3)=84∶100 (2分)
⑵ 设盐酸物质的量浓度为z(mo1·L-1),则
NaHCO3 + HCl=NaCl + H2O + CO2↑
84g 1mol
![]()
![]()
![]()
⑶ 设盐酸过量时生成CO2的体积为V(L),则:
NaHCO3 + HCl=NaCl + H2O + CO2↑
84g 22.4L
![]()
![]()
![]()
⑷ 盐酸的物质的量浓度;如果盐酸不足量,则应该以HCl的量为计算标准,这就须知道盐酸物质的量浓度.(各1分)
22.(9分)
⑴ 0.01mol ⑵ 样品总量为⑴的1.5倍
H2O的物质的量为 ![]()
⑶ ![]()