2004年“东华杯”化学竞赛试题
本试卷可能用到下列元素的相对原子质量(原子量)
H = 1 C = 12 N = 14 O = 16 F = 19 Na = 24 Al = 27 S = 32 Cl = 35.5
K = 39 Ca = 40 Fe = 56 Cu = 64 Zn = 65 Ba = 137
第 I 卷
一、选择题(每题只有1个正确答案,共40分)
⒈意大利化学家阿伏伽德罗(A.Avogadro)在化学上的重大贡献是( )
A. 提出了科学的原子学说 B. 测出了阿伏伽德罗常数的近似值
C. 创立了分子学说 D. 制定了物质的量的单位——摩尔
⒉1molO2的物质的量是1个O2分子量的( )
A. 2×6.02×1023倍 B. 2/3 ×6.02×1023倍
C. 3/2 ×6.02×1023倍 D. 3×6.02×1023倍
⒊不久前,我国科学家首次合成了一种新核素,其符号是18572Hf. 关于18572Hf.的下列说法中正确的是( )
A. 是人类发现的一种新元素 B. 是一种新的原子
C. 其原子核内有113个质子 D. 其原子质量约是12C原子质量的185倍
⒋我国兰州的近代物理研究所曾经研究制出首批重氧气(18O2),其价格远远超过黄金。用NA表示阿付伽德罗常数,下列叙述中正确的是( )
A.22.4L重氧气所含的分子数为NA
B. 1.8g重氧气的物质的量为0.1mol
C.2.0的重(氧)水(1H218O)所含的中子数为NA
D.18g重氧气所含的原子数为2NA
⒌下列离子中最外层电子数为8的是( )
A.Fe3+ B.Li+ C.Ti4+ D.Fe2+
⒍在体积为V L的干燥烧瓶中用排空气法冲入氯化氢气体后,测得烧瓶中气体对氧气的相对密度为1.082。若用此气体进行喷泉实验,在喷泉停止后,进入烧瓶中的液体的体积是( )
A.V L B. 3/4 V L C. 1/2 V L D.1/4 V L
⒎电导仪测得液态BrF3具有微弱的导电性,表示BrF3(液态)中的阴、阳离子Xn-和Yn+存在。Xn-和Yn+也存在于BrF2SbF6、KBrF4、(BrF2)SnF6等化合物中。则Xn-、Yn+的化学式分别为( )
A. Xn- = F- , Yn+ = Br3+ B. Xn- = BrF4- , Yn+ = BrF2+
C. Xn- = F- , Yn+ = BrF2+ D. Xn- = BrF4- , Yn+ = Br3+
⒏一氧化碳和氢气的混合气体共10cm3,完全燃烧时用去5cm3氧气。此混合气体中一氧化碳和氢气的体积比最合理的答案是( )
A.1 : 1 B.2 : 1 C. 3 : 1 D.任意比
⒐下列关于核电荷数1~18的元素的叙述中正确的是( )
A. 最外层只有1个电子的原子一定属于碱金属元素
B. 主族元素的最高正价与其最外层电子数不一定相等
C. 只有卤族元素才能获得1个电子形成稳定的结构
D. 原子核最外层电子数和族序数相等
⒑在100ml含等物质的量的HBr和H2SO3的溶液中通入0.01molCl2,有一半Br-变成Br2.已知SO2能使溴水退色。则原溶液中HBr和H2SO3的浓度都等于( )
A.0.0075mol/L B.0.0080 mol/L C.0.075 mol/L D.0.080 mol/L
⒒人类岁发现新元素的研究始终没有停止过。1999年科学家合成114号元素后,仅仅四个月的时间又传来合成116号118号元素的报告。已知铷(Rb)的原子序数为37。则118号元素位于元素周期表的在( )
A.第五周期 VII A族 B.第六周期 VII A族
C.第七周期 零族 D.第八周期 I A族
⒓取10ml(1:3)的硫酸溶液,加入2g某元素(M)的高价氧化物,再逐渐滴加入5ml 20%NaSiO3溶液,可得到一种黄色胶状物;将它涂敷在白色的滤纸上阴干,即为“酒精测试纸”。此试纸遇“酒气”会由黄色变蓝色。已知M元素的相对原子质量为50,中子数为26,则M元素的符号为( )
A. U B.Cr C.Mn D.Fe
 ⒔世界卫生组织(WHO)将二氧化碳(ClO2)列为A级高效、安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。下列说法正确的是( )
⒔世界卫生组织(WHO)将二氧化碳(ClO2)列为A级高效、安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。下列说法正确的是( )
A. ClO2是强氧化剂 B. ClO2是强还原剂
C. ClO2是离子化合物 D. ClO2中氯元素为-1价
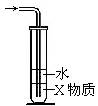
⒕有人设计右图装置吸收氯化氢气体或氨气能取得良好的效果。
由图可 推测(X)可能是( )
A. 苯 B. 甘油 C. 四氯化碳 D. 苯胺
⒖将等体积的氢硫酸与亚硫酸钠溶液混合,并加入适量硫酸,即有黄色 沉淀产生;微热,无酸性气体产生,这表明原混合溶液中H2S和Na2SO3的物质的量之比是( )
A.1:2 B.2:1 C.3:2 D.1:1
⒗超氧化钾(KO2)常用于急救中,发生与Na2O2类似的化学反应。若有156g金属钾在一定条件下完全转化成KO2,用此KO2,吸收足量的CO2时可生成标准状况下的O2是( )
A.22.4L B.11.2L C.44.8L D .67.2
⒘工业上常用侯德榜先生发明的联合制碱法生产碳酸钠(纯碱)和氯化铵,但却不能用此法制取碳酸钾,这是因为在溶液中( )
A. K2CO3融解度较小 B. K2CO3融解度较大
C. KHCO3融解度较小 D. KHCO3融解度较大
⒙分子间存在着范德华力(分子作用间力)的实验事实是( )
A. 食盐、氯化钾等晶体易溶于水 B. 氯气在加压、降温时会变成液氯或固氯
C. 融化的铁水降温可铸成铁锭 D. 金刚石有相当大的硬度
 ⒚六氟化硫(SF6)通常是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如右图所示,呈八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子数为( )
⒚六氟化硫(SF6)通常是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如右图所示,呈八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子数为( )
A. 6种 B. 8种 C. 10种 D. 12种
⒛按规定在食盐中添加一定量的碘化钾(KIO3)即成为可以 为人体补充碘元素的“加碘食盐”。KIO3可用在一定温度下电解KI水溶液的方法制得:
KI+3H2O![]() KIO3+H2↑
KIO3+H2↑
以下关于这一生产得叙述正确的是( )
A. 石磨棒作正极,不锈钢棒作负极
B. 不锈钢棒作阳极,石磨棒作阴极
C. 产生IO3-离子的电极周围溶液pH增大
D. 产生H2电极周围溶液pH增大
21.不久前,欧盟对我国出口酱油进行检测时发现部分酱油中的可能致癌物——3-氯-1,2-丙二醇(CH2OH-CHOH-CH2Cl)严重超出正常标准。为此应对这部分酱油进行化学技术处理。处理过程中应用的化学反应是( )
 A.中和反应 B. 氧化反应 C.消去反应 D.取代反应
A.中和反应 B. 氧化反应 C.消去反应 D.取代反应
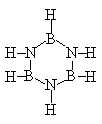
22. 已知化合物硼氮苯(B3N3H6)的分子结构式如右图所示。则硼氮苯
的二氯取代物(B3N3H4Cl2)的同分异构体的数目为( )
A.2 B.3 C.4 D.6
23. 分子式为Pt(NH3)2Cl2的化合物分子构型是平面正方形。它有两
种同分异构体——俗称顺铂(I)和反铂(II),其结构式为:

有关顺铂和反铂的水溶液叙述正确的是( )
A. 顺铂水溶性较好 B.反铂水溶性较好
C. 顺铂、反铂水溶性一样 D.它们的水溶性无法比较
24. NCl3是一种淡黄色的油状液体,分子为三角锥型结构。下列说法正确的是( )
A. NCl3是非极性分子 B.NCl3具有比P Cl3更强的挥发性
C. NCl3能以配位键和Cl-结合 D. NBr3对光很敏感,NCl3不具有光敏性
25. 充分燃烧某液态芳香烃X,并收集产生的全部水蒸气,恢复到室温时,测得水的质量跟原芳香烃的质量相等。则芳香烃X的分子式是( )
A.C10H14 B.C10H16 C.C12H18 D.C12H20
26. 可用来准确鉴别浓硫酸和木炭共热所得产物的试剂及方法是( )
A. 先通入Ba(OH)2溶液,后通入溴水
B. 先通入石灰水,后通入Ba(OH)2溶液
C. 先通入酸性KmnO4溶液,后通入溴水
D. 先通入溴水,后通入石灰水
27. 人体正常的血红蛋白中含有亚铁离子(Fe2+),若误食亚硝酸盐,血红蛋白中Fe2+会转化为Fe3+而使人体中毒。服用维生素C(抗坏血算)可解除亚硝酸盐的毒性。下列叙述中正确的是 ( )
A. 维生素C是氧化剂 B. 维生素C是还原剂
C. 亚硝酸盐能还原亚铁离子 D. 亚硝酸盐能氧化维生素C
28. 质量为25.6g的KOH和KHCO3的混合物,在250oC的密闭容器中充分加热后排出气体、冷却,残留固体20.7g。则原混合物中KOH和KHCO3的物质的量关系正确的是
A. n(KOH) > n(KHCO3) B. n(KOH) < n(KHCO3)
C.n(KOH) = n(KHCO3) D. n(KOH)和 n(KHCO3)为任意比
29. 将a mol 纯铁粉投入含HNO3 b mol的稀溶液中,恰好完全反应并只放出NO气体,则a、b的关系是( )
A.a/b = 1/4 B. a/b = 3/8 C.1/4≤a/b≤3/8 D.无法确定
30.四种水溶液:①HCL, ②FeCl3,③Ba(OH)2,④Na2CO 3测得它们的pH依次为3,4,12,8,而溶液中水的电离度依次为α1、α2、α3、α4,则它们的关系正确的是( )
A. α1>α2>α3>α4 B. α1<α2<α3<α4
C. α2>α4>α1>α3 D. α3>α4>α1>α2
31. 体积相等的甲、乙两个容器中分别都充满有等物质的量的NH3和O2,并在相同的条件下发生反应:4 NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)
达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中NH3的转化率为a%,则乙容器中的NH3的转化率( )
4NO(g)+6H2O(g)
达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中NH3的转化率为a%,则乙容器中的NH3的转化率( )
A.等于a% B.大于a% C.小于a% D.无法判断
32. 普通冰箱使用的氟利昂“泄漏”后可破华臭氧层,所以科学家们正在研究开发新型制冷剂,如“磁制冷剂”。已知磁制冷剂的原子中常具有较多的未成对的电子;在磁场的作用下,电子自旋方向一致到不一致就会向环境吸热而制冷。6年前,美、中等国家已开始这方面的研究。并于2002年制成第一台磁冰箱。研究者最先采用的磁制冷剂是稀土金属(64Gd),我国有丰富的储藏。已知54号元素是Xe,则Gd原子的未成对电子数是( )
A.10 B.9 C.8 D.7
33. 已知每1g葡萄糖完全氧化后能放出15.58kJ能量。某潜水员携带2mol O2,他在水下工作时每1分钟要消耗70kJ能量。问他在水下坚持工作的时间最长为 ( )
A.20分钟 B.14分钟 C.16分钟 D.20分钟
34. 有下列结构的无机橡胶具有优良的耐水性、耐热性、抗热性和低温弹性等优良特性,可用作阻燃、防火、医用材料。
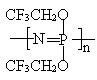
已知:nPCl5+nNH4Cl
![]() (Cl2PN)n+4nHCl (n=3~7)
(Cl2PN)n+4nHCl (n=3~7)
为制得上述无机橡胶、无需使用的物质是( )
A. PCl5和NH4Cl B. CF3CF2OH和Na
C. H2O和NaOH D. KF和HF
35. 有一类组成最简单的有机硅化合物叫硅烷,它的分子组成与烷烃相似。下列有关说法中错误的是( )
A. 硅烷的分子通式可表示为SinH2n+2 B. 甲硅烷(SiH4)的热稳定性强于甲烷
C. 甲硅烷燃烧生成二氧化硅和水 D. 甲硅烷的密度大于甲烷
36. 天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:
CH4+2O2 ![]() CO2+2H2O C3H8+5O2
CO2+2H2O C3H8+5O2
![]() 3CO2+4H2O
3CO2+4H2O
现有一套以天然气为燃料的灶具,今该烧液化石油气,应采取的正确措施是( )
A.减少空气和石油气的进入量 B.增大空气和石油气的进入量
C.减少空气进入量,增大石油气进入量 D.增大空气进入量,减少石油气进入量
37. 以下仪器中,可以不在室温下使用的是( )
A.漏斗 B.量筒 C.移液管 D.滴定管
38. 不能用水浴加热的实验是( )
A. 苯的硝化 B. 乙酸乙酯的水解
C. 乙醇与浓硫酸作用制乙醚 D. 测硝酸钾在水中的溶解度
39. 化学上鉴定S2O32-的方法之一是使用AgNO3溶液作试剂,将溶液逐渐的如含S2O32-的溶液中,会有以下反应:
Ag++2 S2O32-→[Ag(S2O3)2]3- 3 Ag++[Ag(S2O3)2]3-→2 Ag2S2O3
Ag2 S2O3+H2O→Ag2S↓+ H2SO4
对于的S2O32-鉴定,下列叙述不正确的是( )
A. 该鉴定可在酸性或碱性溶液中进行 B. 该鉴定只能在中性溶液中进行
C. AgNO3必须过量 D. S2-对鉴定有干扰
40. 某混合气体可能含有CO、CO2、NH3、HCl、H2和H2O(g)中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸(增重)、灼烧氧化铜(变红)和无水硫酸铜(变蓝)时,则可推定混合气体中一定有( )
A. CO2、HCl、H2 B. CO、H2 、H2O
C. CO、NH3、H2 D. CO、HCl、H2O
二、选择题(每小题有1~2个正确答案,共40分)
41. 以下是部分元素的原子最外层电子数,其中一定属于主族元素的是( )
A.1 B.2 C.3 D. 4
42. 药皂具有杀菌、消毒作用,通常是因为在普通肥皂中加入了适量的( )
A.酒精 B.次硫酸 C.苯酚 D.硫磺
43. 下列物质中属于大气污染物的是( )
A.白色污染物 B.可吸入颗粒物 C.黄曲霉素 D.亚硝酸
44. 人造骨是一种具有生物功能的新型无机非金属材料。它可以依靠从人体液中补充某些离子形成新骨,在骨骼接合界面产生分解、吸收、析出等反应,实现与骨骼牢固结合。人造骨植入人体形成新骨时需要吸收人体中的( )
A.Ca2- B.Cl- C.Na+ D.PO43-
45. 只能用排水法收集的气体是( )
A.CO2 B.C2H4 C.NO D.CH4
46. 二战期间日本侵略者在我国土地上大量地散布了糜烂性毒气——芥子气,其结构式为
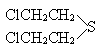 ,毒害了许多无辜地中国人。此毒物除可用氯胺消毒外,还可选用的消毒剂是(
)
,毒害了许多无辜地中国人。此毒物除可用氯胺消毒外,还可选用的消毒剂是(
)
A.盐酸 B.漂白粉 C.氢氧化钠 D.食盐
47. 某温度时,把1mol N2O4气体通入体积为10 L 的真空密闭容器中,立即出现棕色。反应进行4秒钟时,NO2的 浓度为0.04mol/L 再经过一定时间后,反应达到平衡,这时容器内压强为开始时的1.8倍。则下列说法正确的是( )
A. 前4秒钟内,v N2O4 = 0.01mol/(L·S)
B. 在4秒式容器内的压强为开始时的1.2倍
C. 在平衡时容器内含N2O4为0.4mol
D. 在平衡时容器内含NO2为1.6倍
48. 已建立化学平衡的可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述中正确的是( )
A. 生成物的产量一定增大 B. 生成物的百分含量一定增大
C. 反应物的浓度一定降低 D. 反应物至少有一种的转化率一定增大
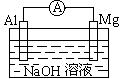 49. 将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、用电器连接成原电池。此电池工作时,下列叙述中正确的是( )
49. 将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、用电器连接成原电池。此电池工作时,下列叙述中正确的是( )
A. Mg比Al活泼,Mg失去电子被氧化成Mg2+
B. Al条表面虽有氧化膜,但可不必处理
C. 该电池的外电路中,电流由Mg极流出,Al极流入
D. 消耗24gMg,电路中将流动2 mol电子
50. 有一种新型的Li—I2电池,其工作时的的化学反应可简化为2Li+I2→2LiI。该电池的使用寿命特长因而可用于心脏起搏器而埋入人体内。关于此电池的下列叙述中正确的是( )
A. 该电池的阴极反应是Li-e → Li+
B. 该电池的负极反应是I2 + 2e → 2I-
C. 该电池只能在无水的条件下才能正常工作
D. 用Zn代替Li得电池的电极质量小时输出电量大
51. 维生素A的结构简式可写成
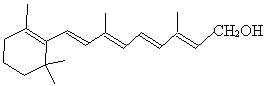
式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子并未标记出来。关于它的以下叙述中正确的是( )
A. 维生素A的分子式为C20H30O
B. 维生素A是一种易溶于水的醇
C. 维生素A的分子式中有异戊二烯的碳键结构
D. 在催化剂作用下,1mol维生素A最多可和7mol H2发生加成反应
52. 已知酸性强弱顺序为H2CO3 > (C6H5)OH > HCO3-,下列化学方程式正确的是( )
A. (C6H5)ONa + H2O +CO2 → (C6H5)OH + NaHCO3
B. (C6H5)ONa + H2O +CO2 → (C6H5)OH + Na2CO3
C. (C6H5)OH + Na2CO3 → (C6H5)ONa + NaHCO3
D. (C6H5)OH + NaHCO3 → (C6H5)ONa + H2CO3
53. 利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为:
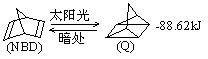
以下叙述中错误的是( )
A. NBD和Q互为同分异构体 B. NBD的内能比Q的内能高
C. Q的一氯代物只有3种 D. NBD的二氯代物可有9种
54. 某些含羟基的药物具有苦味,如以下结构的氯霉素:
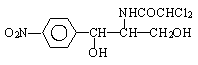
此药物分子种碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团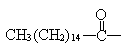 后,苦味消失,成为便于口服的无味氯霉素。以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素。以下关于无味氯霉素的叙述中正确的是( )
A. 它是棕榈酸的盐类 B. 它是棕榈酸的酯类
C. 它的水溶性变差,所以苦味消失 D. 它的水溶性变良,所以苦味消失
55. 某元素构成的双原子单质分子有三种,其式量分别为158、160、162,在天然单质中,此三种单质的物质的量之比为1:2:1。由此推断以下结论正确的是( )
A. 此元素有三种同位素
B. 其中一种同位素的质量数为80
C. 其中质量数为79的同位素原子占总数的1/2
D. 烯元素的单质的平均式量为160
56. 有物质的量浓度、体积都相同的NaF溶液和NaCN溶液。已知HF比HCN较易电离。以下说法中正确的是( )
A. c(Na+) + c(H+) = c (F-) + c(OH-) B. 两溶液中的c(Na+) 、c(H+)分别相等
C. c(Na+) = c (CN-) + c(HCN-) D. NaF溶液中的离子总数较少
57. 将KSCN、NH4HCO3、BaCl2、C6H5OH、NaOH等五种无色溶液鉴别出来的最佳方法是( )
A. 不加任何试剂,将溶液两两混合 B. 不加任何试剂,将溶液分别加热
C. 加入一种试剂 D. 加入两种试剂
58. 室内空气污染的主要来源之一是人们现代生活中所使用的化工产品。如泡沫绝缘材料办公桌、化纤地毯、书报油漆等会不同程度地释放出某种气体,该气体可能是( )
A.氟利昂 B.二氧化碳 C.甲醛 D.甲烷
59. 著名丹麦物理学家尼·玻尔(N·Bohr)将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”:Au + HNO3 +3HCl → AuCl3 +NO +2H2O
AuCl3 +HCl → HAuCl4 (四氯合金酸)
纳粹分子对这种溶液“愚笨得”视而不见、毫无所知。战争结束后,物理学家又根据以下反应,炼出黄金并铸出更加灿烂夺目得奖章:
2 HAuCl4![]() 2HCl↑+Cl2↑+Au
2HCl↑+Cl2↑+Au
表现出伟大科学家对祖国的无比热爱和非凡智慧。尼·玻尔的以上操作中应用的化学原理是( )
A. 王水有很强的氧化性 B. 金离子(在配离子[AuCl4]-中)有很强的氧化性
C. 盐酸有很强的还原性 D. 氯气是上述反应中的氧化剂
60. 最近,我国首次载人航天飞船“神州五号”的发射与返回均获得成功,它标志着我国的航天事业已跻身于世界前列。已知肼(N2H4)是常用火箭燃料,四氯化氮(N2O4)为氧化剂,发生的化学反应是:2 N2H4 + N2O4 → 3N2 + 4H2O +Q (Q>0)
以下说法完全正确的是( )
A. 推动火箭飞行的强大动力源于上述反应产生的气体
B. 火箭燃料燃烧后的氧化产物是N2和H2O
C. 火箭起飞后,保险活动门自动开启,排出部分氧化剂
D. 排出的部分高压氧化剂在空气中氧化成红棕色气体
第 II 卷
相对原子质量:N—14 Ca—20 Cu—64
一、填空或简要回答问题(第61题4分,62—64题各2分,65题3分,66题4分,67题6分,共23分)
61.(1)N2、O2和 NO三种物质中沸点最高的是__________。
(2)如果说有机界的主角是碳,则无机矿物界的主角是________。
(3)铝与NaOH溶液的反应有两种写法:
2Al+2NaOH+2H2O→2NaAlO2+3H2↑
2Al+2NaOH+6H2O→2Na[Al(OH)4]+3H2↑
NaAlO2与Na[Al(OH)4]有什么联系?_________
(4)按电子层的能级交错排列,5g的能级顺序应该在___和___两个能级之间。
62. 原子结构的模型经历了几个重要历史阶段。最早是 Dalton的实心球模型(1808),然后是Thomson的草莓布丁(Plum pudding)模型(1904),Rutherford和Bohr的___模型(1911-1913),直到现代的___模型(1935)。
63. CO2与某些金属、非金属单质或金属氧化物、非金属氧化物在一定条件下都能直接发生反应。请各举一例:金属单质____,菲金属单质_____,菲金属氧化物_____。
64. 为什么有那么多的化学反应需要在水溶液中进行?
65. 不用任何其它试剂,如何将HCI、NaOH、酚酞稀溶液和H2O四种无色液体加以鉴别?
66. 常温下固态 Na和气态 Cl2生成 1mol NaCl晶体释放的能量叫做 NaCl的生成热。生成热△fHNaCl=-4ll kJ/mol。该化合过程亦可被解析成如下四个步骤,各步的能量变化分别表示为△H1、△H2、△H3和△H4:
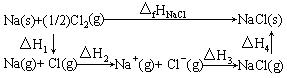
其中△H2=128 kJ/mol,△H3=-526 kJ/mol,△H4=-243 kJ/mol。
则△H1= kJ/mol;NaCl的离子键键能为 kJ/mol;NaCl晶体的晶格能(阴阳离子结合成晶体的能量变化)为 kJ/mol。
67.你认为下列数据是否可信,为什么?
(l)0.2mol/L澄清石灰水。
(2)某磷酸的物质的量浓度为1.4mol/L,此溶液中氢离子浓度接近1mol/L。
(3)某种溶液的浓度超过100%。
二、关于有机化学的填空
(第68-70题每题2分,71题3分,72题4分,73题10分,共23分)。
68. 乙烯酮(CH2=C=O)在一定条件下可与含活泼氢的物质反应,反应的通式可示为:
CH2=C=O+HA→CH2=C(OH)A(极不稳定) →CH3—CA=O。
乙烯酮与什么物质反应可生成乙酸乙酯?______
乙烯酮与什么物质反应可生成醋酸酐?_______
69.将乙醇和浓硫酸混合加热,随温度的逐步提高,可依次得到的有机产物是 、 和乙烯。
70.假定某化合物的分子式为C4O3,它的分子呈单环状,具有一定的对称性,其结构式应是 。
71.化合物C3H6O2,分子不成环,含三种不同环境下的氢原子。请写出所有可能的结构简式。
72.已知 A的化学式为C9H10O3,一定条件下发生下列反应:
A![]() B
B![]() C
C![]() D
D
A、C互为同分异构体(C很难被氧化),它们都能与碳酸钠反应产生二氧化碳;D是含有三个六元环的化合物。写出D的结构简式。
73.(1)以 1,3一丁二烯为基本原料制取 CH2=CClCH=CH2,第一步通过1,4加成制成CH2BrCH=CHCH2Br。以后的中间产物依次是:(用结构简式表示)
(2)以1,3一丁二烯为基本原料制取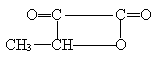 ,第一步可通过1,2一加成生成CH2BrCHBrCH=CH2。请依次写出以后各步的中间产物(用结构简式表示):
,第一步可通过1,2一加成生成CH2BrCHBrCH=CH2。请依次写出以后各步的中间产物(用结构简式表示):
三、写化学方程式
(第74题2分,75题3分,76题4分,77-79题各5分,80题8分,共32分)。
74.以RCOOR’代表某酯,以R"OH代表某醇,写出双方进行“酯交换”反应的化学方程式。
75. Na2SO3受热发生歧化反应,若歧化完全,在产物的水溶液中加稀硫酸不会产生沉淀。歧化产物的水溶液的碱性明显比Na2SO3强。写出该歧化反应方程式:
76.某种炸药的化学式为C8N8O16,据信是迄今最烈性的非核爆炸品。
(1)写出它的爆炸反应方程式。
(2)解释它具有强烈爆炸性的原因。
77. 过二硫酸 H2S2O8及其盐是氧化性比 KmnO4还强的氧化剂。有人认为S在其中的化合价为十7,有人反对。反对的理由是什么?
写出过二硫酸铵在酸性溶液中氧化Mn2+的离子方程式。
78. 将Ag2O+Zn+H2O↔2Ag+Zn(OH)2拆写成两个半反应。若依据这一反应构造一个碱性原电池,电池的正极材料是_____。
79. 有人设计了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸汽。电池的固定电解质是晶格掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子.
(1) 以戊烷代表汽油,该电极负极发生的反应是 。
固体电解质中的O2-向 极方向移动。
(2) 汽油燃料电池的最大问题是电极的气体通道容易被堵塞。造成这种堵塞的主要原因是什么?
80.(1)镛离子方程式表示打苏打用作定影液的基本原理(洗去未感光的AgBr)
(2)NaS2O3溶液与Al(SO4)3溶液混合,写出发生反应的离子方程式。
(3)饲养金鱼用的自来水需经日光曝晒或在敞开的容器中放置一昼夜方可使用。如有急用,需在自来水中溶入少量的大苏打。请用离子方程式表示大苏打的作用。
四、计算题(第81题2分,82题5分,83题7分,84题8分,共22分)
81.已知氧化还原反应平衡常数K的计算式为lgK=(n/0.059) △E0;
E0Hg2+/Hg22+ =+0.92V, E0Hg2+/Hg=+0.78V。
常温下Hg22+=Hg+Hg2+的平衡常数是 。
 82. CsCl晶体中,Cs+的半径为167pm,Cl-的半径为181pm,假定它们在晶体中是紧密接触的,求自立占据整个晶体空间的体积百分数。
82. CsCl晶体中,Cs+的半径为167pm,Cl-的半径为181pm,假定它们在晶体中是紧密接触的,求自立占据整个晶体空间的体积百分数。
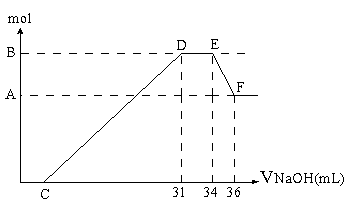
83.现有一定量的铝粉和铁粉的混合物与一定量稀HNO3充分反应,反应过程中无任何气体放出。反应结束侯的溶液中,逐渐加入4mol/LNaOH溶液,所NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示。求:
(1)A的数值:______mol;
(2)B的数值:______mol;
(3)C的数值:______ml.
84. 现取5064g Cu(NO3)2无水晶体,强热使其分解,得到NO2 ,O2和2.32固体氧化物。将气体用水充分吸收后,还有气体剩余,同时得到100ml溶液。
(1)所得溶液的物质的量浓度是________mol/L。
(2)残留固体的成分和质量是__________ 。