§4本章测评
(100分钟100分)
第1卷(选择题共54分)
一、选择题(每小题只有一个正确选项符合题意,每小题3分)
1.下列酸中氧化性最强的是…………………………………………………………( A )
A.HClO4 B. HClO3 C.HClO2 D.HClO
2.下列各组物质中,都能使氯水褪色的是…………………………………………( C )
A.CaCl2、Na2S 、NaOH B.NaOH、NaBr、NaI
C.Ca(OH)2 、H2SO4 、Mg粉 D.Na2SO4、SO2、盐酸
3.能直接使有色布条褪色的是………………………………………………………( D )
A.NaClO B.Ca(ClO)2 C.Cl2 D.HClO
4.制取漂白粉的原料是………………………………………………………………( B )
A.石灰水和Cl2 B.石灰乳和Cl2 C.NaOH和Cl2 D.氧化钙和Cl2
5.除去Cl2中含有的少量水蒸气,所用试剂正确的是……………………………( D )
A.NaOH固体 B.生石灰 C.浓盐酸 D.浓H2SO4
6.下列排列顺序不正确的是…………………………………………………………( D )
A.熔点:Br2 >Cl2 >F2 B.氧化性:Cl2 Br2 >I2
C.还原性:I—>Br—>Cl— D.热稳定性:HI>HBr>HCl>HF
7.在通常状况下,下列保存药品的方法不正确的是………………………………( A )
A.用带磨口玻璃试剂瓶保存NaOH溶液 B.液溴保存在盛有水的棕色玻璃瓶中
C.少量金属钠块保存在煤油中 D.浓盐酸保存在密封的细口玻璃瓶中
8.用漂白粉溶液浸泡过的有色布条,如晾置在空气中,过一段时间,其漂白效果更好的原因是…………………………………………………………………………………( B )
A.漂白粉被氧化了 B.漂白粉和空气中的二氧化碳充分反应生成了次氯酸
C.漂白粉溶液蒸去了部分水分,其浓度增大了 D.有色布条被空气中的氧气氧化了
9.使用试纸检验某试管中逸出的气体的性质时,正确的操作是……………………( D )
A.将干燥的试纸浸入产生气体的溶液中
B.将干燥的试纸放在产生气体的试管口附近
C.先用蒸馏水润湿试纸并粘在玻璃棒一端,再浸入产生气体的溶液中
D.先用蒸馏水润湿试纸并粘在玻璃棒一端,再放到产生气体的试管口附近
10.从单质氟到碘,下列情况中不能反映出它们氧化性强弱不同的是……………( B )
A.单质跟卤化物之间的置换情况 B.跟银结合而形成的卤化银的颜色变化情况
C.跟氢气反应的情况 D.卤化氢的稳定情况
11.下列各组离子在溶液中能大量共存的是…………………………………………( D )
 A.H+、Na+、ClO—、NO3—
B.Ag+、NO3—、Ba2+、Br—
A.H+、Na+、ClO—、NO3—
B.Ag+、NO3—、Ba2+、Br—
C.Ca2+、Na+、HSO4—、OH— D.Mg2+、Ba2+、Cl—、Br—
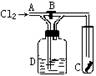
12.如图,A处通入Cl2,关闭B阀时,C处的干燥红布看不到明显现象,打开B阀后,C处红布条逐渐褪色,则D瓶中装的是( A )
A.浓H2SO4 B.NaOH溶液 C.Na2CO3溶液 D.饱和NaCl溶液
13.氯气跟碘在加热条件下反应,生成红棕色液体ICl,性质类似卤素单质
2Zn + 2ICl == ZnI2 +ZnCl2 ICl+H2O =HCl + HIO下列叙述中正确的是…( A )
A.在Zn跟ICl的反应中,ZnI2既是氧化产物,又是还原产物
B.在Zn跟ICl的反应中,ZnCl2既不是氧化产物,又不是还原产物
C.在H2O 跟ICl的反应中,ICl是氧化剂,H2O是还原剂
D.在H2O 跟ICl的反应中,ICl既是氧化剂,又是还原剂
14.下列化学方程式不正确的是……………………………………………………( A )
A.2HClO ![]() 2HCl + O2 ↑ B.2HIH2
+I2
2HCl + O2 ↑ B.2HIH2
+I2
C.F2 + 2NaCl=2NaF + Cl2 D.2KI + Br2 =2KBr + I2
15.向NaBr溶液中通入一定量Cl2后,再加热蒸干并灼烧,所得固体质量不再改变,剩余固体的质量比原溶液中所含NaBr的质量减少0.89g,则被氧化的NaBr的质量是………………………………………………………………………………………( B )
A.1.03 g B.2.06 g C.7.81 g D.无法确定
16.将8.625 g Na投入11.2L(标准状况)平均相对分子质量为30的N2、O2的混合气体中,在一定条件下,使Na与O2充分反应,结果气体平均相对分子质量变为28.8, 成分为…………………………………………………………………………………( B )
A.NaO B.Na2O2 C.Na2O 、Na2O2 D.NaO2
17.在A、B两烧杯中分别加入等物质的量浓度、等体积的稀H2SO4溶液,然后向A中加入m g锌粉,向B中加入m g铁粉,充分反应后,发现一只烧杯中金属有剩余,则A、B两烧杯中的H2SO4的物质的量n值为……………………………………( B )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
18.由Na2SO4 、Na2SO3和Na2S组成的混合粉末,经测定,其中硫元素的质量分数为25.6%,则该混合物中氧元素的质量分数是……………………………………( B )
A.36.8% B.37.6% C.48.6% D.51.2%
第Ⅱ卷(非选择题,共46分)
二、实验题
 19.(13分)下面装置中,A是氯气的发生装置;B、C是净化气体的装置,B中盛水,C中盛浓硫酸;D中装铜丝网;F是吸收多余气体的装置。
19.(13分)下面装置中,A是氯气的发生装置;B、C是净化气体的装置,B中盛水,C中盛浓硫酸;D中装铜丝网;F是吸收多余气体的装置。
(1)反应前A的分液漏斗中装的药品是 浓HCl ,烧瓶中装的药品是 MnO2 。
(2)通过B是为了除去 HCl ;通过C是为了除去 H2O (g) 。
(3)写出A、D、F中发生的化学反应方程式,属于氧化还原反应的,标明电子转移的方向和数目。
失2e— 失2e—
![]()
![]() MnO2 + 4HCl(浓)
MnCl2
+ Cl2↑+ 2H2O Cu + Cl2
MnO2 + 4HCl(浓)
MnCl2
+ Cl2↑+ 2H2O Cu + Cl2 ![]() CuCl2
CuCl2
得2e— 得2e—
失1e—
![]()
![]() Cl2 + 2NaOH=
NaCl + NaClO + H2O
Cl2 + 2NaOH=
NaCl + NaClO + H2O
得1e—
(4)D中有何现象: 产生棕黄色烟 ,冷却后将所得产物溶于水配成饱和溶液,溶液呈
绿 色。
(5)E的作用 防止F中的溶液倒吸
三、填空题
2O.(11分)某无色晶体A与浓硫酸在微热条件下产生一种在空气中冒白雾的气体F;F与黑色粉末G在加热条件下生成另一种气体E;将E的水溶液滴入D盐溶液时,生成两种物质A和B,其中B能使淀粉溶液呈现特殊的蓝色:往A的溶液中滴入AgNO3溶液,立即产生白色沉淀物C,该白色沉淀物不溶于稀HNO3,对D盐进行焰色反应实验,透过蓝色钻玻璃观察到灼烧时呈紫色。试回答。
(1)A、B、C、D,E、F、G的化学式。
A KCl 、B I2 、C AgCl 、D KI 、E Cl2 、F HCl 、G MnO2 。
(2)写出上述变化的四个化学方程式。
①A与浓硫酸共热: KCl + H2SO4 (浓) KHSO4 + HCl↑ 。
②F与G作用: MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O 。
③E与D反应: 2KI + Cl2 =2KCl + I2 。
④A和AgNO3 溶液混合: KCl + AgNO3 = AgCl↓+ KNO3 。
21.(6分)已知A、B、C、D四种物质关系如下:
A + KOH(浓) B + C + H2O C B + D C + HCl(浓) ![]() A + B + H2O
A + B + H2O
A、D常温下是气体单质,由此可推断A是 Cl2 、B是 KCl 、C是 KClO3 、D是 O2 ,写出A与KOH反应的化学方程式,并标出电子转移的方向和数目。氧化剂与还原剂的物质的量之比为 5∶1
失5e—
3Cl2 + 16KOH(浓) 5KCl + KClO3 + 3H2O
![]()
得5e—
四、计算题
22.(7分)有H2和Cl2的混合气体100mL(标准状况下),其中一种气体的体积为45mL,另一种气体的体积为55mL,光照使两种气体发生反应,反应后恢复到标准状况,气体体积为 100 mL,为证明反应后气体中H2或Cl2剩余,使气体通过10mL水,并使剩余气体干燥后恢复到标准状况,若:
(1)剩余有 10 mL气体,证明 H2 剩余,理由是H2难溶于水而HCl极易溶于水 。
(2)溶液有 漂白 性质,证明 Cl2 有剩余,理由是 Cl2和H2O反应生成具有漂白作用的HClO 。
23.(9分)向含有a mol Ca(OH)2 的石灰水中通入b mol CO2 ,可得沉淀多少克?
答案:①当a≥b时,沉淀为100 b g;②当b≥2a 时,沉淀为0 g;③当a<b<2a时,沉淀为100(2a — b) g。