第二节 卤族元素
Ⅰ.学习重点:
1.掌握卤族元素性质变化的规律
2.了解可逆反应的涵义
3.掌握卤离子的检验方法
4.了解卤化银的性质、用途及碘与人体健康的有关知识
Ⅱ.学习难点:
卤族元素的性质比较及变化规律
Ⅲ.训练习题
一、选择题
1.卤族元素随核电荷数的增加,下列叙述正确的是( )
A.单质的颜色逐渐加深 B.气态氢化物的稳定性逐渐增强
C.单质的熔点逐渐升高 D.单质的氧化性逐渐增强
2.砹(At)是卤素中核电荷数最多的元素,推测砹或砹的化合物下列性质错误的是( )
A.砹为有色固体 B.HAt很稳定
C.AgAt不溶于水 D.砹单质熔沸点比碘单质熔沸点高
3.按元素核电荷数递增的顺序,下列各项递变逐渐减弱或减小的是( )
A.卤素单质的氧化性 B.卤素阴离子的半径
C.卤素阴离子的还原性 D.卤化氢的稳定性
4.不能将溴水、碘水中的溴、碘萃取出来的溶剂是( )
A.四氯化碳 B.直馏汽油 C.酒精 D.苯
5.溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,能与许多非金属单质反应生成相应卤化物,能与水反应等。其与水反应的方程式为
IBr+H2O![]() HBr+HIO 下列关于IBr的叙述中不正确的是( )
HBr+HIO 下列关于IBr的叙述中不正确的是( )
A.IBr是一种有色物质
B.在许多反应中IBr是强氧化剂
C.在IBr与水的反应中,它既是氧化剂又是还原剂
D.与NaOH溶液反应生成NaIO
6.能用加热方法除去下列物质中括号内的杂质的是( )
A.KClO3(MnO2) B.Na2CO3(NaHCO3)
C.NaCl(KCl) D.KI(I2)
7.在甲、乙、丙三种溶液中各含一种卤素离子,往甲中加淀粉和氯水,则溶液变蓝色,再往丙中加淀粉和氯水,无明显现象。则甲、乙、丙依次含有( )
A.Br-、I-、Cl- B.Cl-、I-、Br-
C.I-、Br-、Cl- D.Br-、Cl-、I-
8.向含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A.KCl B.NaCl和KCl C.NaCl和KBr D.NaCl、KCl和I2
9.鉴别NaCl、NaBr、NaI三种溶液可以选用的试剂是( )
A.碘水、淀粉溶液 B.溴水、汽油
C.氯水、四氯化碳 D.硝酸银溶液、稀硝酸
10.下列方法可用于制备卤化氢气体的是( )
A.NaCl与浓HNO3加热热制备HCl
B.CaF2与浓H2SO4加热制备HF
C.NaBr与浓H3PO4加热制备HBr
D.NaI与浓H2SO4加热制备HI
11.取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是( )
A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:1
12.氟化氢水溶液叫氢氟酸,它应贮存在( )
A.玻璃瓶中 B.铅容器中 C.瓷瓶中 D.塑料瓶中
13.某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完成后,该比值变为3:2:1,则反应的Cl2与原溶液中I-的物质的量之比是( )
A.1:2 B.1:3 C.1:4 D.1:6
14.下列各组溶液不用其他试剂,就可以将它们区别开的是( )
A.盐酸、NaOH、Na2CO3、Na2SO4
B.盐酸、AgNO3、NaOH、NaNO3
C.NaOH、MgSO4、Na2CO3、NaHSO4
D.BaCl2、Na2SO4、CaCl2、Ca(NO3)2
15.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3-可和I-发生反应:IO3-+5I-+6H+![]() 3I2+3H2O。根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀汾试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是( )
3I2+3H2O。根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀汾试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是( )
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
16.方志敏烈士生前在狱中曾用米汤(内含淀粉)给鲁迅先生写信,鲁迅先生收到信后,为了看清信中的内容,使用的化学试剂是( )
A.碘化钾 B.碘酒 C.溴水 D.碘化钾淀粉溶液
17.向碘化钾溶液中加入硝酸银溶液,直到完全反应时为止,结果反应后溶液的质量恰好等于反应前原碘化钾溶液的质量。则加入硝酸银溶液的质量分数为( )
A .72.3% B.50% C.38.3% D.38%
18.在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反应中,当有mg的Cl2被氧化时,被还原的Cl2有( )
KClO3+5KCl+3H2O的反应中,当有mg的Cl2被氧化时,被还原的Cl2有( )
A.6m/35.5mol B.5m/71mol C.3mg D.5mg
19.向含有20.6g NaBr溶液中通入Cl2后,将溶液蒸干得固体16.15g,则下列说法正确的是( )
A.NaBr全部转化为NaCl B.50%的Br-离子被氧化
C.Br-未被氧化 D.16.15g固体由NaCl和NaBr组成
20.已知Fe2+与Cl2在溶液中因发生氧化还原反应不能共存,现将过量的Cl2通入FeBr2溶液中,下列离子方程式正确的是( )
A.2Fe2++4Br-+3Cl2![]() 2Fe3++6Cl-+2Br2
2Fe3++6Cl-+2Br2
B.2Fe2++2Br-+2Cl2![]() 2Fe3++4Cl-+Br2
2Fe3++4Cl-+Br2
C.2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D.2Br-+Cl2![]() Br2+2Cl-
Br2+2Cl-
二、填空题
21.现有以下几种溶液①NaCl②FeCl2③MgBr2④KI⑤NH4F等
(1)能跟氯水混合而共存的是
(2)有跟溴水混合而共存的是
(3)能跟碘水混合而共存的是
(4)能跟硝酸混合而共存的是
22.久置的盛KMnO4溶液的滴瓶,瓶壁上沾有的褐色物质是 ,除去的方法是(用化学方程式表示) 。
23.在金属卤化物中,能用于人工降雨的物质是 ,用于制作照相感光底片的物质是 。
24.盛有溴水的试管里加入过量镁粉,充分振荡、过滤,将滤液分装于A、B、C三支试管:
(1)A试管中加入AgNO3溶液,现象是
(2)B试管中加入氯水和CCl4,振荡,现象是
(3)C试管中加NaOH溶液,现象是
25.A、B、C、D、E、F六种物质间的关系如下:
(1)A+KOH![]() B+C+H2O
B+C+H2O
(2)D![]() C+E
C+E
(3)D+C+H2SO4![]() A+F+H2O
A+F+H2O
已知A和E是单质,常温下是气体,F是硫酸盐。写出六种物质化学式:A
B C D E F 。
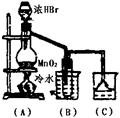 26.根据右图的实验,填空和回答问题:
26.根据右图的实验,填空和回答问题:
(1)烧瓶中所发生的主要反应的化学方程式是
装置(B)的烧杯中冷水所起的作用是
装置(C)的烧杯中冷水所起的作用是
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互靠紧,这是因为
(3)装置(C)的烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因 。
三、计算题
27.将一定量氯气通入250ml KBr溶液中,反应后将固体蒸干,测知所得固体中含溴元素10g,且K+与Cl-的物质的量之比为2:1。求:
(1)通入氯气的体积(标准状况).
(2)原溴化钾溶液的物质的量浓度.
28.293K时,在0.5L饱和Cu(IO3)2溶液中,加入足量的KI和稀硫酸的混合液,充分反应后生成CuI,K2SO4和H2O,反应方程式为:
2Cu(IO3)2+24KI+12H2SO4![]() 2CuI↓+13I2+12K2SO4+12H2O
2CuI↓+13I2+12K2SO4+12H2O
过滤除去CuI沉淀后,在溶液中滴入几滴淀粉溶液,溶液变蓝,再用0.11mol/L Na0S2O3溶液滴定,已知滴定过程的反应是:
2Na2S2O3+I2![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
当用去117mL Na2S2O3溶液时,溶液的蓝色恰好褪去。求在293K时,Cu(IO3)2的溶解度为多少g?(设293K时,饱和Cu(IO3)2溶液的密度为1g/cm3)
参考答案
一、1.AC 2.B 3.AD 4.C 5.C 6.BD 7.C 8.B 9.CD 10.BC 11.C 12.BD 13.B 14.BC 15.B 16.B 17.A 18.BD 19.BD 20.A
二、21.(1)①⑤ (2)①③⑤ (3)①③④⑤
(4)① 22.MnO2 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 24.AgI AgBr 24.(1)生成淡黄色沉淀 (2)分层,下层橙红色 (3)生成白色沉淀 25.Cl2 KClO KCl KClO3
O2 K2SO4 26.(1)NaBr+H2SO4(浓)
MnCl2+Cl2↑+2H2O 24.AgI AgBr 24.(1)生成淡黄色沉淀 (2)分层,下层橙红色 (3)生成白色沉淀 25.Cl2 KClO KCl KClO3
O2 K2SO4 26.(1)NaBr+H2SO4(浓) ![]() NaHSO4+HBr↑ MnO2+4HBr
NaHSO4+HBr↑ MnO2+4HBr![]() MnBr2+Br2↑+2H2O,冷凝,吸收未冷凝的气体 (2)溴蒸气会腐蚀橡皮管 (3)当气体被吸收时,液体上升到漏斗中,由于漏斗的容积大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中液体又流回烧杯内,从而防止了倒吸。
MnBr2+Br2↑+2H2O,冷凝,吸收未冷凝的气体 (2)溴蒸气会腐蚀橡皮管 (3)当气体被吸收时,液体上升到漏斗中,由于漏斗的容积大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中液体又流回烧杯内,从而防止了倒吸。
三、27.(1)1.4L (2)1.0mol/L 28. 0.124g