2005~2006学年度第一学期期末调研考试
高一化学试题
(本试卷卷面总分:100分,考试时间:100 min,考试形式:闭卷)
| 题 号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得 分 |
|
|
|
|
|
|
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
K-39 Mn-55 Fe-56 Cu-64
第Ⅰ卷(选择题,共48分)
注意:请将选择题答案填入下表中:
| 题 号 | 一 | 二 | ||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列物质不是电解质的是
A.H2SO4 B.KOH C.N2 D.NaCl
2.下列物质的用途错误的是
A.硅是制造太阳能电池的常用材料 B.二氧化硅是制造光导纤维的材料
C.水玻璃可用作木材防火剂 D.硅是制取水泥的原料
3.下列实验事故处理的方法中,不正确的是
A.炒菜时,油锅里着火了,可倒入冷油灭火
B.不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液
C.如果汽油、煤油等可燃物着火,可立即用水扑灭
D.酒精灯不慎碰翻着火,应立即用湿布盖灭
4.氢氧化铁胶体属于介稳体系的主要原因是
A.胶粒直径小于1nm B.胶粒带正电荷
C.胶粒作布朗运动 D.胶粒不能通过半透膜
5.测得某黄铜矿(CuFeS2)中含硫20%,则该矿石含铜的质量分数是
A.10% B.20% C.30% D.40%
6.下列关于铝的叙述中,不正确的是
A.铝是地壳里含量最多的金属元素 B.铝是一种比较活泼的金属
C.在常温下,铝不能与氧气反应 D.化学反应中铝容易失电子,是还原剂
7.下列化学反应的离子方程式,书写不正确的是
A.碳酸钙加入稀盐酸: CaCO3+2H+=Ca2+ +CO2↑+H2O
B.铜片加入稀硫酸并加热:Cu+2H2SO4(浓) △ Cu2++SO42--+SO2↑+2H2O
C.钾跟冷水反应: 2K+2H2O=2K++2OH- +H2↑
D.氢氧化铝溶于硝酸: Al(OH)3 + 3H+=Al3++3H2O
8.在Na2S、S8、( )、BaSO4的排列中,括号内应填入的物质的化学式是
A.Na2SO4 B.KHSO3 C.H2S D.SO3
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.加热KHCO3固体到质量不再减少时,称得固体质量比起初减少31g ,则参加反应的KHCO3固体质量为
A.100 g B.138 g C.200 g D.338 g
10.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色;②石蕊试剂;③品红溶液
A.只有①② B.只有①③ C.只有②③ D.①②③
11.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
A.偏二甲肼(C2H8N2)的摩尔质量为60g/mol
B.6.02×1023个偏二甲肼(C2H8N2)分子的质量在数值上与其摩尔质量相等
C.1 mol 偏二甲肼(C2H8N2)中共含有12 mol原子
D.6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
12.现有H、O、S、Na四种元素,它们之间可以组成的氧化物种类有
A.三种 B.四种 C.五种 D.六种
13.盐城市从2005年12月份起开始推广使用含乙醇汽油。燃料乙醇与一般的商品酒精不同,是以玉米、小麦、薯类、高粱、甘蔗、甜菜等为原料,经发酵、蒸馏制得乙醇,脱水后再添加变性剂变性的乙醇。推广使用车用乙醇汽油可以减少对石油资源的依赖,有效缓解我国石油资源短缺的状况。下列有关说法错误的是
A.燃料乙醇是一种绿色可再生资源 B.使用标准乙醇汽油后污染物浓度会降低
C.推广乙醇汽油有利于促进农业发展 D.推广乙醇汽油汽车就不会产生污染
14.各取下列物质1 mol ①氧化钠 ②氢氧化钠 ③过氧化钠 ④亚硫酸钠。长期放置在空气中,最后质量增加的情况是(不考虑潮解因素)
A.①=②>③>④ B.②>①=③>④ C.①>③>④>② D.④>②>③>①
15.铜粉加入稀盐酸中,加热无现象,这时加入一种盐则铜粉溶解而溶液变蓝,同时有气体放出,这种盐是
A.NaCl B.KNO3 C.FeCl2 D. Fe2(SO4)3
16.要使100 g含水99%的食盐水变成含水98%的食盐水,下列方法可行的有
A. 加入2 g食盐 B. 蒸发50 g水
C. 蒸发 49 g水 D. 加入100 g质量分数为3%的食盐水
第II卷(非选择题,共52分)
三、(本题包括4小题,共24分)
17.(6分)有人在研究硫酸亚铁受热分解反应时,作了两种假设:
⑴假设它按氯酸钾受热分解的方式来分解,反应的化学方程式为:
⑵假设它按碳酸钙受热分解的方式来分解,反应的化学方程式为:
⑶事实上,硫酸亚铁分解为氧化铁,二氧化硫,三氧化硫(分解温度为500℃左右),则反应化学方程式为:
18.(6分)“比较”是化学研究物质性质的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2 生成。
19.(6分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:
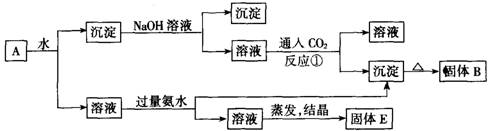
据此判断:
(1)固体B所含物质的化学式为 。
(2)固体E所含物质的化学式为 。
(3)反应①的离子方程式为 。
20.(5分)某校高一研究性学习小组将造成我市空气污染的主要原因分为下列四种:
A.燃烧农作物秸秆 B.燃烧含硫煤 C.粉尘污染 D.机动车尾气污染
设计的问题是:你认为造成我市空气污染的最主要的原因是什么?并就此调查了我市100位市民和100位环保部门人士,调查结果如下图所示:
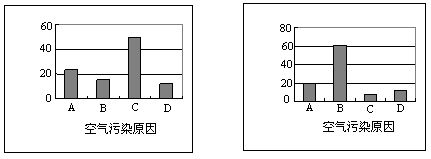 |
图一 :市民的观点 图二:环保人士的观点
⑴我市市民认为造成我市空气污染的最主要的原因是 ,环保人士认为造成我市空气污染的最主要的原因是 。
⑵上述调查结果说明我市市民对造成空气污染的原因认识不足。该原因造成的大气污染的主要有害成分是 ,空气中该成分含量较高时,在空气中的氧气和水的共同作用下,会形成酸雾,其变化的反应方程式可表示为 。
( 5分 )(⑴粉尘污染 ( 1分) 燃烧含硫煤 ( 1分)
⑵SO2 ( 1分) 2SO2+O2+2H2O = 2H2SO4 ( 2分)
四、(本题包括2小题,共17分)
21.(9分)下面是某同学研究氯水漂白性的一个探究性实验片断。
活动计录
[观察] 氯气的颜色:黄绿色;氯水的颜色:浅黄绿色。
[结论]氯水中含有氯气。
[实验操作] 用两根玻璃棒分别蘸取盐酸和氯水,各滴在两片蓝色石蕊试纸上。
[实验现象] 滴有盐酸的试纸变红,滴有氯水的试纸中间变白,外圈变红。
[分析与结论] 氯水呈黄绿色,说明氯水中溶有游离的氯气。滴有氯水的蓝色石蕊试纸外圈变红,说明氯水中有能使试纸变红的酸生成;中间变白,说明氯水中有能够使有色物质褪色的物质生成。
[问题与思考] 氯气溶于水发生如下反应:C12+H2O=HCl+HClO,溶液中的水和盐酸都没有漂白作用,能够使有色物质褪色的物质是氯水中的氯气还是氯水中的次氯酸呢? 还是二
者都有漂白作用?
请你参照他已完成的部分实验活动记录,自己设计一个实验,证明到底是哪种物质有漂白作用。
[实验操作] __________________________________________________________________
____________________________________________________________________________。
[可能的实验现象]_____________________________________________________________
____________________________________________________________________________。
[分析与结论]_________________________________________________________________
___________________________________________________________________________。
22.(8分)下列物质中都含有杂质(括号内为杂质),试选用合适的试剂和分离方法除去杂质。
填写下表:
| 含杂质的物质 | 除杂试剂 | 分离方法 | 反应的化学方程式 |
| (1)CO2(SO2) | |||
| (2)NaCl固体(NaI) |
五、(本题包括2小题,共11分)
23.(5分)在Na2SO4和硫酸的混合溶液100 mL中,加入100 mL 2 mol / L BaCl2溶液时,恰好使![]() 全部沉淀。过滤,在滤液中加入足量锌粒,完全反应后收集到的气体为3.36 L(标准状况)。计算原混合液中硫酸和硫酸钠溶液的物质的量浓度。
全部沉淀。过滤,在滤液中加入足量锌粒,完全反应后收集到的气体为3.36 L(标准状况)。计算原混合液中硫酸和硫酸钠溶液的物质的量浓度。
24.(6分)0.06 mol KMnO4固体,加热一段时间后,收集到a mol 气体,在反应后的残留固体中加入足量的浓盐酸,又收集到b mol 气体,设此时Mn元素全部以Mn2+存在于溶液中,则:
(1)a+b的取值范围为 ;
(2)计算若a+b=0.13 mol 时,加热一段时间后残留固体的质量为多少克?
2005~2006学年度第一学期期末调研考试
高一化学试题参考答案
第Ⅰ卷(共48分)
| 题 号 | 一 | 二 | ||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | |
| 答案 | C | D | C | B | B | C | B | B | A | D | AC | D | D | C | B | BD |
第Ⅱ卷(共52分)
17. (6分,每空2分)
⑴FeSO4 △ FeS +2O2↑ ⑵ FeSO4 △ FeO +SO3↑ ⑶ 2FeSO4 △ Fe2O3 +SO2↑+SO3
18.(6分,方程式每个2分,其余每空1分)
(1)SO2+Na2O2=Na2SO4 2SO3+2Na2O2=2Na2SO4+O2(2)2 (3)最高
19.(6分,每空2分)(1) Al2O3 (2) (NH4)2SO4和K2SO4
(3) AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
20.( 6分 )(⑴粉尘污染 ( 1分) 燃烧含硫煤 ( 1分)
⑵燃烧含硫煤( 1分) SO2 ( 1分) 2SO2+O2+2H2O = 2H2SO4 ( 2分)
21.( 9分 )(干燥的氯气和干燥的试纸中不含HCIO和水,可供设计实验。只要方法合理,叙述规范,每空可给3分)
22.( 8分 )
(1)饱和NaHCO3 溶液 ( 1分) 洗气( 1分) 方程式( 2分)略
(2)氯水( 1分) 蒸发结晶( 1分) 方程式( 2分)略
23.( 5分 )n(BaSO4)=2 mol / L×0.1L=0.2 mol
Zn + 2HCl = ZnCl2 + H2
n(H2)=![]() =0.15 mol n(HCl)=0.3 mol
(
1分)
=0.15 mol n(HCl)=0.3 mol
(
1分)
H2SO4 + BaCl2 = BaSO4¯ + 2HCl
0.15 mol 0.15 mol 0.3 mol ( 1分)
Na2SO4 + BaCl2 = BaSO4¯ + 2NaCl
0.2 mol-0.15 mol
0.05 =0.05 mol ( 1分)
c(Na2SO4)=![]() =0.5 mol / L (
1分)
=0.5 mol / L (
1分)
c(H2SO4)=![]() =1.5 mol / L ( 1分)
=1.5 mol / L ( 1分)
24.( 6分 )(1)0.12≤(a+b)<0.15 ( 2分)
(2)计算出 KMnO4 分解0.04 mol ( 2分) 计算出 O2 质量为0.64 g ( 1分)
残留固体的质量为8.84 g ( 1分)
说明:上述解答过程有所简化,其他合理解答均可酌情给分。