江苏省苏州实验中学
2005-2006第一学期期末考试试卷
高 一 化 学
可能用到的相对原子质量H-1 He-4 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 Ca-40 Fe-56 Cu-64 Zn-65
第一卷 (选择题 共72分)
一、选择题(本题共24小题,每题3分,每题有一或二个选项符合题意,若正确答案只包括一个选项,多选为0分,若正确答案包括两个选项,只选一个且正确的得一半分,但只要选错一个,该小题为0分.)
1.我国的“神州六号”载人飞船已发射成功并返回,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是: ( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
2.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是( )
A.有丁达尔效应 B.能全部透过半透膜
C.不能透过滤纸 D.所得分散系不稳定
3.下列实验设计方案中,可行的是 ( )
A.用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3
B.用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
C.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42-
D.先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开
4.设NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.1 mol NH4+ 所含质子数为10NA
B.10克氖气所含原子数约为6.02×1023
C.标准状况下,22.4 L SO2所含的分子数为NA
D.常温常压下,32 g O2所含原子数为2NA
5.苹果汁是人们喜爱的饮料。由于饮料中含有![]() 离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使
离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使![]() 转变为
转变为![]() 离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有: ( )
离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有: ( )
A.氧化性 B.还原性 C.酸性 D.碱性
6.配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
A.所用NaOH已吸潮 B.向容量瓶加水时液面高于刻度线
C.有少量NaOH溶液残留在烧杯内 D.向容量瓶加水时眼睛一直俯视液面
7.在化学反应![]() 中,当有1.5摩铜被氧化时
( )
中,当有1.5摩铜被氧化时
( )
A.有4mol硝酸被还原 B.有1mol硝酸被还原
C.转移6mol电子 D.转移3mol电子
8.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A.NaCl Na2SO4 B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
9.在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为 ( )
A.![]()
![]() B.
B.![]()
C.![]() D.
D.![]()
10.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
11.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是 ( )
A.Fe-2e=Fe2+ B.2Fe+2H2O+O2=2Fe(OH)2↓
C.2H2O+O2+4e=4OH- D.Fe-3e=Fe3+
12.在PH=1的无色溶液中一定可以大量共存的离子组是( )
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- MnO4-
C.K+ Na+ Cl- AlO2- D.K+ NH+4 SO42- SiO32-
13.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有 ( )
A.①②⑥ B.全部 C.①③④⑤ D.②③⑥
14.在一定体积18mol·L-1浓硫酸中加入过量的铜片,并加热,被还原的H2SO4为0.9mol,则浓硫酸的实际体积为 ( )
A.大于100mL B.等于50mL C.等于100mL D.大于50mL
15.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是 ( )
A.NaOH B.NH3·H2O C.AgNO3 D.BaCl2
16.下列离子方程式书写正确的是 ( )
A.氯气和冷水反应 :Cl2 + H2O == 2H+ + Cl- +ClO-
B.金属钠跟水反应: Na+2H2O == Na++2OH-+H2↑
C.铝和烧碱溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.AlCl3溶液中加入过量氨水:Al3++4OH- = AlO2-+2H2O
17.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为 ( )
A.1:1 B.2:1 C.3:1 D.1:3
18.下列溶液有时呈黄色,其中由于久置时被空气中氧气氧化而变色的是 ( )
A.浓硝酸 B.硫酸亚铁 C.碘化氢溶液 D.工业盐酸
19.科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是 ( )
A.自然界硅的贮量丰富 B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片 D.光导纤维的主要成分是Si
20.有许多单质或化合物,易溶于含同一元素的盐(或酸)溶液或熔融体(或液体)中,如I2易溶于KI溶液中,S易溶于K2S溶液中,KF易溶于液态HF中,下列工业生产中应用了上述相似的溶解原理的是 ( )
A.炼铁 B.炼铝 C.制发烟硫酸 D.合成氨
21.赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应: Cu2S + 2Cu2O![]() 6Cu + SO2↑下列对于该反应的说法中,正确的是
(
)
6Cu + SO2↑下列对于该反应的说法中,正确的是
(
)
A.该反应中的氧化剂只有Cu2O B.Cu2S在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物 D.氧化产物是SO2还原产物是Cu
22.根据所给的4个反应,判断下列4种物质的氧化性由强到弱的正确顺序是( )
(1)Cl2 + 2KI == 2KCl + I2 (2) 2FeCl2 + Cl2 == 2FeCl3
(3)2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2 (4) H2S +I2==S ↓+2HI
A.S>I2>Fe3+>Cl2 B.Cl2> Fe3+>I2>S
C. Fe3+> Cl2>.S>I2 D. Cl2>I2>Fe3+>S
23.由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应,收集到标准状况下的氢气11.2L,则混合物中一定含有的金属是 ( )
A.锌 B.铁 C.铝 D.镁
24.下列实验用来证明SO2的存在,其中正确的是 ( )
A.能使品红褪色,加热后又出现红色 B.能使湿润的蓝色石蕊试纸变红
C.通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸
D.通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸。
第二卷(非选择题 共78分)
二、实验题:
25.(4分)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有____________________(填代号,限填三项)。
A.试管 B。瓷坩埚 C。坩埚钳 D。铁三角架
E.泥三角 F.酒精灯 G。烧杯 H。量筒
(2)第2步:I- 溶液的获取。操作是_________________________________________.
(3)第3步:氧化。操作时依次加入合适的试剂。下列氧化剂最好选用___________(填代号)
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是_______________________________________________.
(4)第4步:碘单质的检验。操作时取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
26.(5分)对一份白色固体,经过初步分析得知,其含有Na2CO3、Na2SO4、NaCl、CuSO4等物质中的一种或几种。甲乙两位同学为了进一步确定这份白色固体的组成成份而进行了如下实验,但实验中的有些问题还需你来作答。
(1) 甲取少量白色固体在试管内用水溶解,结果得无色澄清的液体。因此,甲说肯定有一种物质不存在。这种物质的化学式是:______________
(2) 甲又先后向那试管内加入了稍过量的BaCl2溶液和稀硝酸,结果是先产生了白色沉淀,后又有一部分沉淀消失并从溶液里冒出无色气泡。因此甲又说肯定有两种物质存在。这两种物质是:______________、_____________。
(3) 乙将甲所得混合物进行了过滤,取滤液约2ml盛于另一支洁净的试管里,然后又向该试管内加入了稍过量的AgNO3溶液和稀硝酸,结果也产生了白色沉淀。因此乙说那份白色固体中也肯定有NaCl。你说乙的结论(填“对”或“不对”)__________,理由是:________________
27.(9分)实验室中用浓盐酸与MnO2制取Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高易发生副反应:
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通过):
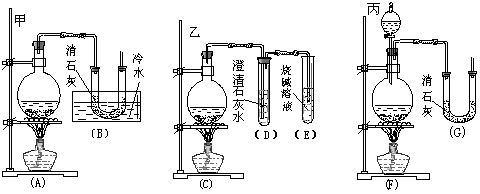
(1)请从以下从六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内:
a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生
d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右的方向)为 ;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因
。
(3)如果反应前加入了m g Ca(OH)2,反应结束并冷却后倒出固体物质称量为n g(设反应中产生的水仍留在固体物质中)。则该固体物质中Ca(ClO)2的质量分数的表达式为(不必化简): 。
三、填空题:
28.Ⅰ。(6分)工业上用碳在高温下还原二氧化硅的方法,制得含有少量杂质的粗硅,将粗硅在高温下跟氯气反应生成四氯化硅,四氯化硅再用氢气还原,就可以得到高纯度的硅。写出上述发生反应的化学方程式:(1)___________________;(2)_________________________;(3)_______________________________.
Ⅱ(2分)防治碘缺乏病的碘添加剂是KIO3(如加碘盐),可用盐酸酸化的KI淀粉混合液检验食盐是否加碘,其反应的离子方程式为: 。
Ⅲ.(4分)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。试写出
(1)(CN)2与KOH溶液反应的离子方程式:
_________________________________________________________________;
(2)在KSCN的溶液中加入(CN)2,反应的离子方程式:
_____________________________________________________________________。
Ⅳ.(2分)某学生在实验室用NH4NO3和锌粉按质量比8:6.5混合,放在温热的石棉网上,并滴数滴水于混合粉末上即产生大量的白烟(ZnO),经查资料知发生后有氮气和水生成。请写出该反应的化学方程式__________________________________________.
Ⅴ.(4分)燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染。
(1)使排放的烟气通过氨水洗涤,化学方程式是
(2)在煤中加适量生石灰,使SO2与生石灰反应,化学方程式为 _________.
Ⅵ.(2分)汽车尾气置换装置放入的催化剂能将汽车尾气中的一氧化碳和一氧化氮转化为无害气体,其化学方程式为___________________________________.
Ⅶ。(2分)我国化工专家侯德榜发明的侯氏制碱法是将二氧化碳通入氨水的氯化钠饱和溶液中,由于碳酸氢钠溶解度较小,碳酸氢钠从溶液中析出。写出该反应的化学方程式______________.
29.(4分)A元素原子最外层电子数比次外层少2个电子,且不是稀有元素,B元素与A元素的原子核外电子层数相同,B元素原子最外层只有1个电子.则:
(1)B元素的原子结构示意图为_____________,(2)A、B两元素形成的化合物的化学式为______________.
30.(4分)向FeCl3溶液中加入ag铜粉,搅拌使之全部溶解,再向其中加入 bg铁粉,充分反应后过滤得滤渣 cg,若已知 a>b>c,则 c克滤渣是______。溶液中存在的阳离子是____ __。
31。(2分)电解熔融的氧化铝,若有0.2mol电子发生转移,则理论上得到金属铝________克.
32.(4分)将铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀是______,残渣是________________.(写化学式)
33.(4分)加热碳酸钠和碳酸氢钠95g,使其完全分解,得到标准状况下气体5.6升,则混合物中碳酸钠的质量分数为_____________________.剩余固体物质质量为___________g.
34、(8)下图为一些常见物质的转化关系图。已知:①电解C溶液的反应是无机化工生产中的一种重要反应,②Q、M为常见单质 ③F、L是含有同一种元素的化合物,该元素在两种化合物中的化合价不同。
|
|
|
|
|
![]()
![]()
![]()
|
|
 | |||||
 | |||||
稀盐酸
|
|
试回答下列问题:![]()
![]()
(1)B、D的化学式为:B D
(2)完成下列反应的化学方程式:
F + L → M + H2O
(3)R与NaOH溶液反应的离子方程式
四、计算题:
35.(6分)某小型氯碱厂采用电解氯化钠溶液的方法生产氢氧化钠。该工厂平均每天生产的氢氧化钠20t.试问:
(1)理论上,该工厂平均每天生产标准状况下的氯气的体积为多少?
(2)该工厂平均每天至少需要多少吨的氯化钠?
36.(6分)在由Fe、Fe2O3组成的混合物中加入100mL2mol·L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中加入KSCN溶液无明显现象,求反应前混合物中Fe、Fe2O3的物质的量。
高一化学期末考试答题卷
二、实验题:
25.(1)______________ , (2)__________________________________________.
(3)______________ ,_________________________________________________.
26.(1)______________ , (2)_______________、__________________
(3)___________,____________________________________________________.
27.(1)
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(2)______________,___________________________________________.
(3)____________________.
三、填空题:
28.Ⅰ(1)______________________________ (2)__________________________.
(3)_______________________________.
Ⅱ._____________________________________.
Ⅲ.(1)______________________________ (2)__________________________.
Ⅳ._________________________________
Ⅴ.(1)______________________________(2)____________________________.
Ⅵ.__________________________________.
Ⅶ.____________________________________.
29.(1)_____________________,(2)____________________.
30.______________________,_________________________.
31.___________________. 32_____________,_________________.
33.____________________,_____________________.
34.(1)_______________,_____________________.
(2)__________________________________ (3)_______________________________.
四、计算题.
35.
36.
高一化学期末试卷参考答案
1B 2A 3AD 4CD 5B 6D 7BD 8AB 9B 10C 11D 12A 13C 14A 15A 16C 17C 18BC 19AC 20B 21BD 22B 23C 24AD(每题3分…1.5分)
25. (1)B E F
(2)将灰烬转移到烧杯中,加适量蒸馏水,用玻棒充分搅拌,溶解,煮沸,过滤
(3)D 过氧化氢是绿色氧化剂,在氧化过程中不引进杂质,不产生污染,不会进一步氧化碘。
26. (1)CuSO4 (2) Na2CO3 、Na2SO4 (3)不对、因为在步骤(2)中加入BaCl2引进了Cl-
27. (1)
| 优点 | 缺点 | |
| 甲装置 | d | ae |
| 乙装置 | f | ac |
| 丙装置 | b | ce |
(2)F~B~E 在Cl2中混有HCl,应在烧瓶和凹形管之间连接一个盛有饱和食盐水的试管,以除去HCl气体。
(3)143(n—m)/142n×100%
28. Ⅰ.SiO2 + 2C == Si + 2CO Si+2Cl2==SiCl4 SiCl4+H2==Si+4HCl
Ⅱ.IO3-+5I-+6H+ ==I2 + 3H2O
Ⅲ. (CN)2+2OH-==CN-+CNO-+H2O ② 2SCN -+(CN)2==2CN -+ (SCN)2
Ⅳ.NH4NO3+Zn==ZnO+N2+2H2O
Ⅴ.SO2+H2O+2NH3 == (NH4)2SO3 或NH4HSO3 SO2+CaO==CaSO3 或2SO2+2CaO+O2=2CaSO4
Ⅵ.2CO+2NO==N2+2CO2 Ⅶ.NaCl+NH3+H2O+CO2==NaHCO3+NH4Cl
29. (+11) 2 8 1 Na2S 30. Cu Fe2+、Cu2+
31.1.8g 32.Fe(OH)3 ,Fe2O3 33.55.8% , 79.5g
34. (1)FeCl2 , FeS
(2)SO2 + 2H2S === 3S + 2H2O (3)Al2O3 + 2 OH— === 2 AlO2— + H2O)
35.(1)5.6×106L (2)29.25t
36. 设混合物中Fe的物质的量为x,Fe2O3的物质的量为y,反应生成H2需Fe的物质的量为a
Fe ~ H2
1mol 22.4L
a 0.224L a=0.01mol
Fe2O3 ~ 2Fe3+ ~ Fe
1mol 1mol
y (x-0.01mol)
![]() y= x-0.01mol
y= x-0.01mol
2x+2y·2=0.1L·2mol/L (Cl元素守恒)
解得:x=0.04mol y=0.03 mol (其他正确解答参照给分)