氧族元素练习题
班级_______姓名________得分________
1. 下图为固体物质A及其产物发生的一系列反应的框图,每一个方框内表示有一种反应物或生成物(反应条件及反应所需和生成的水均已略去),其中A、G为反应物,C、F在常温下均为气体:
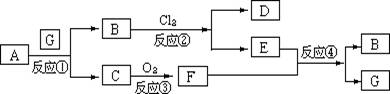
(1)试写出B和C的分子式: 。
(2)写出把F通入到E物质的水溶液中所发生的反应④的离子方程式:
________________________________________________________________.
2. 将x摩尔H2S和1摩尔O2置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101千帕),在常温下测得反应前后容器内气体密度分别为d1和d2,若x的取值不同,则H2S的氧化产物可能有以下三种情况(忽略气体的溶解):
(1)全部是SO2,此时的x的取值范围是 ,且d1 d2(填大于、等于、小于)
(2)全部是S,此时x的取值范围是
(3)部分是S,部分是SO2,此时x的取值范围是 ,容器内气体的物质的量为 摩(用含x的关系式表示).
3. 某无色溶液可能含有下列钠盐中的几种:
(A)氯化钠、(B)硫化钠、(C)亚硫酸钠、(D)硫代硫酸钠、(E)硫酸钠、(F)碳酸钠。
向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题:
(1)不能使品红试液褪色,说明该气体中不含 (填分子式)。
(2)此无色溶液至少存在哪几种盐?请写出全部可能的情况(填写相应的字母):
第一种情况是: ;
第二种情况是: ;
第三种情况是: ;
第四种情况是: 。
4. 有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z,X、Y、Z之间也能相互发生反应。已知X是由a和b元素按原子个数比1︰1组成的化合物,其他元素形成的单质(仍用a、b、c表示)和组成的化合物之间的反应关系如下(未配平):
Ⅰ、b+c→Y Ⅱ、a+c→Z Ⅲ、X+Y→m Ⅳ、X+Z→c+n Ⅴ、Y+Z→c+n
(1)上述反应中,最有充分理由说明该反应一定属于氧化还原反应的是 (填反应编号).
(2)如果m是一种无色粘稠油状液体化合物,则X、Y、Z的化学式分别是:
、 、 。
(3)Ⅲ步反应的化学方程式是 。
(4)Ⅳ步反应的化学方程式是 。
5. 近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸汽副产品,试写出上述两步反应的化学方程式。
6. 有两种无机盐A和B,其分子量都是120,为了确定A和B,将它们分别溶于水制成溶液,进行下列实验:
①将两种溶液混合立即产生一种易溶于水、易液化的气体;
②在两种溶液中分别加入氯化钡溶液,A溶液无沉淀产生,B溶液里有白色沉淀析出;
③在两种溶液里分别加入过量的氢氧化钡溶液均有白色沉淀产生。
则A B两种盐分别为 和 (写物质名称)。
7. 某种铁的硫化物6克,在空气中完全燃烧生成铁的氧化物和二氧化硫,将生成的二氧化硫通入碘水中可将25.4克碘元素还原为I-,由此可知,这种铁的硫化物的分子式为 。
8. 19.6克铁粉和8克硫粉混合后放入密闭容器中加热,充分反应后冷却,再加入250毫升一定物质的量浓度的盐酸恰好完全反应。试求:
(1)反应后可生成标准状况下的气体多少升?
(2)所加盐酸的物质的量浓度为多大?
9. m克铁粉和n克硫粉混和共热后(不考虑Fe与O2)的反应,将反应混和物溶于足量的稀盐酸中,则标况下可产生气体。
10. 取50毫升Na2CO3和Na2SO4的混和溶液,加入过量氯化钡溶液后得到14.51克白色沉淀,用过稀硝酸处理后沉淀减少到4.66克,并有气体放出.试计算:
(1)原混和溶液中Na2CO3和Na2SO4的物质的量的浓度;
(2)产生的气体在标准状况下的体积。
 11. 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如右图的转变关系,试回答:
11. 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如右图的转变关系,试回答:
(1)A是 、B是 、C是 。
(2)B的物质的量为x,氧气的物质的量为y,则当B跟氧气恰好反应,完全转化为A时,x与y的数值关系为 ;若当B转化为C时,反应后,常温下体系中只有C一种气体,x与y的数值关系是 。
12. 有一混和物由硫化钠、亚硫酸钠和硫酸钠组成,经测定含硫25.6%,求该混和物中氧元素的质量分数。
13. 在常温常压下,100毫升H2S与O2的混和气体在一定条件下完全反应,恢复到原状态时,最后得到气体25毫升,试求最后得到的气体是什么?原混和气体中两种气体各占多少毫升?
14. 有一长期放置的亚硫酸钠固体,其中已有一部分被氧化成为硫酸钠,经定量分析已知含硫的质量分数为25%,求该样品中亚硫酸钠的质量分数和氧化率及钠、氧的质量分数。
15. 把29克铁和硫的混和物在密闭条件下加热反应,冷却至室温,再加入足量稀硫酸后,放出的气体在标准状况下为8.4升,则混和物中硫和铁的物质量之比为 。
16. 将a摩H2S和1摩O2置于一个密闭容器中在120℃时反应,a的取值范围是________;反应后生成SO2和H2O(气)的物质的量之和为_______摩。
17. 现有硫酸和硫酸钠的混和溶液200L,其中硫酸的浓度为1mol/L,硫酸钠的浓度为0.5mol/L,要使硫酸和硫酸钠的浓度变为2mol/L和0.2mol/L,应加入55.8%的硫酸溶液(d=1.35g/L)多少升后再加蒸馏水配制?
18. 焙烧1.10克黄铁矿,将形成的焙砂在氢气流中加热使其充分反。这样得到的物质在加热下用过量盐酸处理,向此溶液中加入双氧水并用氨饱和。定量地分离出形成的沉淀,将其溶解在盐酸中,加入过量的碘化钾。为了使得到的溶液褪色,准确地消耗了50升0.1摩/升的硫代硫酸钠溶液。
(1)写出所有的化学反应方程式;
(2)计算黄铁矿中杂质的含量(假设所有反应都是定量进行的)。
19. 某空气污染监测仪是根据SO2和Br2的定量反应来监测空气中SO2含量的。其中Br2来自一个装满有酸性(H2SO4)溴化钾溶液的电解槽阳极上的氧化反应,电解槽阳极室与阴极室是隔开的。测某地区空气中的SO2含量时,空气经过机械除尘以1.5×10-4米3/分的流速进入电解槽的阳极室 ,电流计上测得每秒通过的电子是8.56×10-11摩,能保持溴浓度恒定并恰好与SO2完全反应,若被测空气中不含有其它与溴反应的物质:
(1)写出监测过程中所发生的主要反就的化学方程式 ;
(2)计算该地区空气中SO2的含量(克/米3空气)
20. 常温常压下,50毫升H2S与60毫升O2混和点燃充分反应后恢复到原状态,可生成SO2多少毫升?
 21. 某工厂排出的废水中含有氯气,为了除去废水中的游离氯,且使废水变为中性,有人提出如图所示的方案:在废水排出管的A B处分别注入一定量的废烧碱溶液和亚硫酸钠溶液,已知氯气和亚硫酸钠溶液的反应如下:Cl2+Na2SO3+H2O=Na2SO4+2HCl
21. 某工厂排出的废水中含有氯气,为了除去废水中的游离氯,且使废水变为中性,有人提出如图所示的方案:在废水排出管的A B处分别注入一定量的废烧碱溶液和亚硫酸钠溶液,已知氯气和亚硫酸钠溶液的反应如下:Cl2+Na2SO3+H2O=Na2SO4+2HCl
(1)A、B处应加入的物质的化学式依次为 和 ;
(2)A、B处发生的反应的离子方程式是:A ;B ;
22. 已知氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(固体)![]() Ca2++2OH-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
Ca2++2OH-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写出上述反应的两个化学方程式:
①在空气中的SO2与碳酸钙悬浊液反应 ,
②在空气中的SO2与熟石灰悬浊液反应 。
(2)试说明通常用熟石灰悬浊液,而不用澄清石灰水洗涤废气的理由:
(3)在英国进行的一个研究表明:高烟囱可以有效地降低地面SO2浓度。在20世纪60—70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建高烟囱使地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?
23. 某硫酸厂用接触法制硫酸的生产过程中,在锻烧黄铁矿时损失硫为5%(质量分数);在SO2的催化氧化时有92%的二氧化硫转化为三氧化硫;在吸收塔中损失SO3为0.6%(质量分数)。现有含FeS2 95%的黄铁矿(杂质不含硫元素)100t,问可制得98%的浓硫酸多少吨?
24. 将8.8g FeS固体置于200 mL 2.0 mol/L的盐酸中,以制备H2S气体。反应完全后,若溶液中H2S的浓度为0.10 mol/L,假定溶液体积不变,试计算:
(1)收集到H2S气体的体积(STP);
(2)溶液中Fe2+和H+的物质的量浓度。
25. 接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的10000m3尾气中含有0.2%(体积百分数)的二氧化硫,问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到 kg石膏(CaSO4·2H2O)。
(2)如果将一定体积的尾气通入100mL 2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
[1] (1)B为FeSO4 C为H2S (2)SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
[1] (1)x≤2/3 d1<d2 (2)x≥2 (3)2/3<x<2
[1] (1)SO2 (2)B、C、F B、D、F
[1] (1)Ⅰ、Ⅱ、Ⅳ、Ⅴ (2)H2O2 SO2 H2S (3)H2O2+SO2=H2SO4 (4)H2O2+H2S=S↓+2H2O
[1] Na2SO3+SO2+H2O=2NaHSO3、2NaHSO3=Na2SO3+SO2↑+H2O
[1] A 亚硫酸氢钾;B 硫酸氢钾
[1] FeS2
[1] (1)7.84升 (2)2.8摩/升
[1] 0.4m升
[1] (1)c(Na2SO4)=0.40摩/升;c(Na2CO3)=1摩/升 (2)1.12升
[1] (1)S H2S SO2 (2)y=x/2 x/2<y≤3x/2
[1] 37.6%
[1] 当硫化氢过量时,硫化氢与氧气的体积分别是75毫升和25毫升;当最后得到的气体是二氧化硫时,两种气体的体积都是50毫升
[1] 39.06%
[1] 硫︰铁=3︰2
[1] (1)2/3<a<2 (2)1+a/2
[1] 104.1升
[1] (1)4FeS2+11O2=2Fe2O3+8SO2 Fe2O3+3H2=2Fe+3H2O Fe+2HCl=FeCl2+H2↑ 2FeCl2+H2O2+4NH3+4H2O=2Fe(OH)3↓+4NH4Cl Fe(OH)3+3HCl=FeCl3+3H2O 2FeCl3+2KI=2FeCl2+I2+2KCl I2+2Na2S2O3=Na2S4O6+2NaI (2)45.4%
[1] 1.096×10-3克/米3
[1] 35毫升
[1] (1)Na2SO3 NaOH (2)Cl2+SO32-+H2O=SO42++2H++2Cl- H++OH-=H2O
[1] (1)①2SO2+O2+2CaCO3=2CaSO4+2CO2 ②2SO2+O2+2Ca(OH)2=2CaSO4+2H2O (2)Ca(OH)2微溶于水,澄清石灰水中Ca(OH)2浓度较小,熟石灰悬浊液含Ca(OH)2较多,吸收SO2的量多,速度也快 (3)不可取。因SO2的排放总量并未减少,产生的酸雨仍会造成全球性的危害
[1] 142.55t
[1] (1)1.8L (2)0.50mol/L 1mol/L
[1] (1) (2)NaHSO3 0.1mol;Na2SO3 0.05mol (3)x≤1/2 0;1/2<x<1 2n(SO2)-n(NaOH);n≥1 n(NaOH)