九十學年度臺灣省高中化學實驗能力競賽實作I
編號
雙質子酸衍生鹽混合物:含量分析
[I] 實驗說明
高中化學課程曾介紹單質子酸與多質子酸的異同。以硝酸與碳酸為例,每莫耳
硝酸僅能與一莫耳氫氧化鈉反應:
HNO3(aq) + NaOH(aq) ----> NaNO3(aq) + H2O(l) (1)
因此硝酸為單質子酸;若如碳酸,因具有兩個可游離的質子,每莫耳碳酸可與兩莫耳氫氧化鈉進行反應,所以屬於雙質子酸:
H2CO3(aq) + 2NaOH(aq) ----> 2H2O(l) + CO32-(aq) + 2Na+(aq) (2)
雙質子酸雖然具有兩個可游離的質子,卻不意味每個氫離子的解離難易完全一致,例如碳酸的兩個質子,其解離常數則為4.3 x10-7與4.8 x10-11:
H2CO3(aq) ----> H+(aq) + HCO3-(aq), Ka1 = 4.3 x10-7 (3)
HCO3-(aq) ----> H+(aq) + CO32-(aq), Ka2 = 4.8 x10-11 (4)
也由於此一緣故,碳酸根與碳酸氫根離子水解時,產生氫氧根離子的難易度也有所差異:
CO32-(aq) + H2O(l) ----> HCO3-(aq) + OH-(aq), Kb1 = 2.1 x10-4 (5)
HCO3-(aq) + H2O(l) ----> H2CO3(aq) ) + OH-(aq), Kb2 = 2.3 x10-8 (6)
因此,若以0.1 M鹽酸滴定二質子酸的共軛鹼(Na2X,0.1 M)時,便會呈現如下圖所示的滴定曲線:
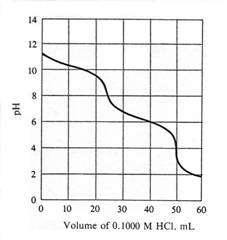
一般而言,若欲分析溶液中H2X或其共軛鹼的濃度,可利用酸鹼滴定及適當指示劑施行之。然而,若缺乏適當指示劑時,亦可藉由pH儀(或稱氫離子電極)進行分析。本實驗即是利用pH儀進行虛擬實驗,探討某雙質子酸的共軛鹼混合物:NaHX與Na2X之含量。
[II] 試藥與設備:
1.Na2X與NaHX混合物,0.360 g
2.標準鹽酸溶液(0.1 ~ 0.2 M),200 mL
3.標準Na2X溶液(0.1 ~ 0.2 M),200 mL
4.滴定管(50 mL)兩支含固定架,一組
5.錐形瓶(100 mL), 兩支
6.玻璃漏斗, 一支
7.量筒(50 mL), 一支
8.容量瓶(50 mL) , 一支
9.燒杯(100, 50 mL) , 各一支
10.拭紙,若干張
11.滴管(1 mL,含橡皮套),一支
12.原子筆(紅、藍),各一支
13.作圖紙 (方格紙),兩張
[III] 實驗步驟:
請依下列虛擬實驗步驟,對Na2X與NaHX混合物含量進行分析,無須真正操作:
1. Na2X與NaHX混合物溶液製備:
領取0.360 g的Na2X與NaHX混合物。將之倒入燒杯中後,先以少許標準的
Na2X溶液溶解之。迨完全溶解後,再以足量的Na2X標準溶液將之製備成50.0 mL的溶液。此時你需要哪一種器具,始能確實製備出50.0 mL的上述溶液?請根據桌上所陳列的器皿,選出一種,寫出其名稱:_____________________。
2. 取出25.00 mL的上述溶液,將之置於一只100-mL的錐形瓶中,準備以鹽酸
定之。如何準確量取25.00 mL的上述混合溶液?請根據桌上所陳列的器皿,選出一種,寫出其名稱:_____________________。
3. 領取50 mL的標準鹽酸溶液,將之傾入滴定管中。先以數滴潤濕滴定管,再填滿滴定管。勿使滴定管內含有氣泡。記錄刻度。此時你需要哪一種器具,始能有效地將鹽酸溶液傾入滴定管中?根據桌上所陳列的器皿,選出一種,並寫出其名稱:_____________________。
4. 於錐形瓶下襯入一張白紙,再將玻璃電極(pH儀)置入溶液內。
5. 逐滴加入鹽酸溶液;記錄刻度與pH值。
6. 所得數據紀錄於表(一)。
7. 利用繪圖紙,以紅原子筆將pH值對鹽酸添加體積作圖,並於圖上指出滴定終點。
8. 依照相似步驟,對25.00 mL的標準Na2X溶液進行滴定。紀錄數據於表(二)。
9. 於同一張繪圖紙上,以藍原子筆繪出pH值對鹽酸體積的滴定曲線,並指出滴定終點。
10. 實驗完畢後,依指示清理桌面與廢溶液。
11. 以清水清洗、潤溼玻璃器皿;打開滴定管活拴,並以自來水及蒸餾水沖洗,再將倒掛於鐵架上。再以清水潤溼玻璃電極,並套上保護套。
[IV] 問題回答:
(1) 對於步驟 (1),你需要哪一種器具,始能確實製備出50.0 mL的溶液?
器皿名稱:_____________________。
(2) 對於步驟(2),如何準確量取25.00 mL的上述混合溶液?請根據桌上所陳列的器皿,選出一種,其名稱為:_____________________。
(3) 對於步驟(3),你需要哪一種器具,始能有效地將鹽酸溶液傾入滴定管中?
其名稱:_____________________。
(4) 試問此雙質子酸(H2X)的第一及第二游離常數值為何?試估計其pKa1與pKa2
答: pKa1 (pKa1 = -logKa1):_________;pKa2 (pKa2 = -logKa2):_____________。
(上述答案的有效數字至小數點第一位即可)
(5) 滴定曲線中多出現兩段轉折,試問第一段轉折意義為何?第二段轉折又有何意義?
答:
(6) 試根據所得滴定曲線,判斷混合物中Na2X與NaHX的含量。已知Na2X與NaHX的式量分別為:100.0 g與78.0 g。
答:Na2X:_______ g;NaHX:_______ g。
(7) 試問標準Na2X溶液之濃度為何?
答: [Na2X]:_______ M。
(8) 試問鹽酸溶液之濃度為何?
答:[HCl]:_______ M。
表(一)以HCl滴定Na2X與NaHX混合物之數據
| 欄位 | 鹽酸體積/mL | pH | 欄位 | 鹽酸體積/mL | pH |
| 1 | 0.00 | 11.00 | 24 | 45.45 | 6.42 |
| 2 | 4.55 | 10.50 | 25 | 50.00 | 6.32 |
| 3 | 9.10 | 10.20 | 26 | 52.25 | 6.24 |
| 4 | 13.65 | 9.70 | 27 | 54.55 | 6.17 |
| 5 | 18.20 | 9.30 | 28 | 56.80 | 6.07 |
| 6 | 21.60 | 8.76 | 29 | 59.10 | 5.99 |
| 7 | 22.75 | 8.55 | 30 | 61.35 | 5.88 |
| 8 | 23.85 | 8.28 | 31 | 63.65 | 5.76 |
| 9 | 25.00 | 7.99 | 32 | 65.90 | 5.61 |
| 10 | 26.15 | 7.75 | 33 | 68.20 | 5.40 |
| 11 | 27.25 | 7.59 | 34 | 69.30 | 5.22 |
| 12 | 28.40 | 7.42 | 35 | 70.45 | 4.98 |
| 13 | 29.55 | 7.31 | 36 | 72.75 | 3.34 |
| 14 | 30.70 | 7.21 | 37 | 73.85 | 3.00 |
| 15 | 31.80 | 7.11 | 38 | 75.00 | 2.85 |
| 16 | 32.95 | 7.04 | 39 | 76.15 | 2.73 |
| 17 | 35.25 | 6.96 | 40 | 77.25 | 2.65 |
| 18 | 36.35 | 6.90 | 41 | 79.55 | 2.53 |
| 19 | 37.50 | 6.84 | 42 | 84.10 | 2.37 |
| 20 | 38.65 | 6.74 | 43 | 88.65 | 2.27 |
| 21 | 39.75 | 6.69 | 44 | 95.45 | 2.15 |
| 22 | 40.90 | 6.64 | |||
| 23 | 43.20 | 6.51 |
表(二)以HCl滴定Na2X標準溶液之數據
| 欄位 | 鹽酸體積/mL | pH | 欄位 | 鹽酸體積/mL | pH |
| 1 | 0.00 | 11.33 | 26 | 38.65 | 6.27 |
| 2 | 4.55 | 10.70 | 27 | 40.90 | 6.13 |
| 3 | 9.10 | 10.27 | 28 | 43.20 | 5.95 |
| 4 | 13.65 | 9.93 | 29 | 45.45 | 5.71 |
| 5 | 18.20 | 9.58 | 30 | 46.60 | 5.57 |
| 6 | 22.75 | 9.00 | 31 | 47.15 | 5.44 |
| 7 | 23.85 | 8.62 | 32 | 47.75 | 5.36 |
| 8 | 24.45 | 8.35 | 33 | 47.95 | 5.30 |
| 9 | 25.00 | 8.14 | 34 | 48.30 | 5.19 |
| 10 | 26.15 | 7.94 | 35 | 48.65 | 5.00 |
| 11 | 26.70 | 7.61 | 36 | 48.85 | 4.91 |
| 12 | 27.25 | 7.47 | 37 | 49.10 | 4.80 |
| 13 | 27.85 | 7.34 | 38 | 49.45 | 4.33 |
| 14 | 28.40 | 7.24 | 39 | 50.00 | 3.39 |
| 15 | 29.00 | 7.14 | 40 | 50.60 | 3.09 |
| 16 | 29.55 | 7.06 | 41 | 51.15 | 2.96 |
| 17 | 30.10 | 6.98 | 42 | 52.25 | 2.76 |
| 18 | 30.70 | 6.91 | 43 | 53.40 | 2.63 |
| 19 | 31.25 | 6.85 | 44 | 55.70 | 2.46 |
| 20 | 31.80 | 6.85 | 45 | 59.10 | 2.31 |
| 21 | 32.40 | 6.74 | 46 | 63.65 | 2.17 |
| 22 | 32.95 | 6.69 | 47 | 68.20 | 2.08 |
| 23 | 33.50 | 6.64 | 48 | 72.75 | 2.02 |
| 24 | 34.10 | 6.59 | 49 | 77.30 | 1.96 |
| 25 | 36.35 | 6.43 | 50 | 81.80 | 1.96 |