黄石二中理科实验班复试试题
命题人:高存勇 时间:90分钟 满分:100分 2006. 7. 21
一、选择题(每小题有一个或者两个正确答案。错选不得分,漏选得1分,每小题3分,共60分。选择题答案必须填入答题卡中)
1.下列说法正确的是
A.等体积、等物质的量浓度的强酸中所含的H+数一定相等
B.同物质的量浓度同体积的任何溶液中所含溶质微粒数目相同
C.标准状况下,NA个H2O分子所占的体积约为22.4 L
D.无论什么状况下,一定质量的某种气体含有的分子数是一定的
2.下列说法正确的是
A.醋酸溶液的导电能力一定不如盐酸强 B.硫酸溶液在通直流电条件下发生电离
C.铁是单质,它不是电解质,属非电解质
D.碳酸氢铵溶液既可与盐酸反应又能与氢氧化钠溶液反应
3.已知反应 Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.氧化剂是O2 D.1 mol Cu参加反应有2 mol电子发生转移
4.某同学从一种未知的无色溶液中检验出含有Ba2+和Ag+,同时测得溶液的pH=1,他还准备继续检验溶液中是否还含有下列离子:Cl-、S2-、CO32-、SO42-、Cu2+、NO3-、K+、Al3+、NH4+、PO43-,你认为其中不必检验的离子有 A.4种 B.5种 C.6种 D.7种
5.有FeSO4、CuSO4混合液300mL,其中SO42-浓度为0.1mol·L-1,投入一些锌粉,反应后得到一些固体沉淀,经测定沉淀为Cu、Fe,不含Zn,溶液中还有0.01mol Fe2+。据此,可知投放的锌粉质量是 A.1.3g B.2.6g C.3.9g D.6.5g
6.某溶液中含有Cl-、SO42-、Fe3+、K+、M,且离子物质的量之比为2∶3∶1∶3∶1,则微粒M可能为: A.Na+ B.Mg2+ C.Al3+ D.Ba2+
7.下列离子方程式书写正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
B.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3—+2OH—====CaCO3↓+ 2H2O + CO32—
C.醋酸钡溶液和硫酸反应:Ba2++SO42-== BaSO4↓
D.向酸性FeSO4溶液中加H2O2溶液: 2Fe2+ + 2H2O2 + 4H+ ==2Fe3+ + 4H2O
8.下列叙述正确的是
A.某可溶物的摩尔质量大于18g/mol,则该物质饱和溶液的密度一定大于1g/cm3
B.氯化钠饱和溶液的质量分数为a%,该温度下氯化钠的溶解度为Sg,则a一定小于S
C.将质量分数分别为90%与10%的H2SO4等体积混合,其质量分数一定等于50%
D.饱和KCl溶液密度为ρg/cm3,物质的量浓度为c mol/L,则KCl的质量分数为(74.5c/1000ρ)×100%
9.若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1乙醇溶液的质量分数,且知2ω1=ω2,则下列推断正确的是(乙醇的密度比纯水的小,且乙醇浓度越大密度越小):
A .a<b<2a B .2b=a C .b>2a D .2a=b
10.在常温下,发生下列几种反应:
①16H++10Z-+2XO![]() =2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-
=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-
根据上述反应,判断下列结论中错误的是
A.溶液中可发生:Z2+2A2+=2A3++2Z- B.Z2在①、③反应中为还原剂
C.氧化性强弱的顺序为:XO![]() >Z2>B2>A3+ D.X2+是XO
>Z2>B2>A3+ D.X2+是XO![]() 的还原产物
的还原产物
11.从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O====7Cu2S+5FeSO4+12H2SO4.(已知FeS2中S为-1价)
下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物 D.FeS2只作还原剂
12.下列离子方程式中,正确的是
A.向氯化亚铁溶液中通入氯气 Fe2++Cl2 Fe3++2Cl-
B.三氯化铁溶液跟过量氨水反应 Fe3++3NH3·H2O Fe(OH)3↓+3NH![]()
C.碳酸氢钙溶液跟稀硝酸反应 Ca(HCO3)2+2H+ Ca2++2H2O+2CO2↑
D.氯气通入冷的氢氧化钠溶液中 2Cl2+2OH- 3Cl-+ClO-+H2O
13.下列微粒①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-
既具有氧化性又具有还原性的是
A.①④⑤⑦ B.③⑥⑦⑧ C.④⑤⑥⑧ D.①②③⑥
14.向Ba(OH)2溶液中逐滴滴入稀H2SO4至过量,则溶液的导电能力,下列叙述正确的是
A.开始时,导电能力肯定最强 B.当沉淀为最大值时,导电性最弱
C.先变强,后变弱 D.逐渐变弱
15.已知某溶液的①体积 ②密度 ③溶质和溶剂的质量比 ④溶质的摩尔质量。要根据溶
质的溶解度,计算其饱和溶液的物质的量浓度时,上述条件中必不可少的是 A.①②③④ B.①②③ C.②④ D.①④
16.在密闭容器中充入C02、CO、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg;则C02与CH4的体积比为
A.3:1 B.2:l C.1:1 D.缺少条件,无法计算
17.使VL0.5 mol/L 的HCl溶液的浓度增大一倍可采用的方法是
A.加入0.125VL5 mol/L 盐酸 B.通入标准状况下HCl气体11.2L
C.加热浓缩溶液至0.5VL D.加入10 mol/L 盐酸0.1VL 后加水稀释至1.5VL
18.水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是
A.1L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.1L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH D.该水蒸气冷凝后,测氢氧原子比
19.有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2克,把它们溶于足量的水中,充分反应后,溶液中的Ca2+、CO32-和HCO3-均转化为沉淀,将反应容器中的水分蒸干,最后得到白色固体共29克,则原混合物中Na2CO3的质量为
A.10.6克 B.5.3克 C.5.9克 D.无法确定
20.某干燥粉末可能由Na2O 、Na202、Na2C03、 NaHC03、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
A.粉末中一定有Na20、Na202、NaHC03 B.粉末中一定不含有Na2C03和NaCl
C.粉末中一定不含有Na20和NaCl D.无法确定
选择题答题卡(选择题答案必须填入以下答题卡中):
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
二、填空题(共22分):
21.(4分)由于错误操作, 使得到的数据比正确数据偏小的是 (填写编号)
A.用量筒量取一定量液体时, 俯视液面读数
B.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有烘干
E.定容滴加蒸馏水时,液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
22.(6分)今年7、8月份我国南方大部分地区干旱少雨,许多地区用单级火箭发射碘化银进行人工降雨。小火箭使用的主要燃料名叫“偏二甲肼”。现取3.0g偏二甲肼在氧气中充分燃烧后生成4.4gCO2、3.6gH2O和1.4gN2三种物质,由此可知偏二甲肼由 种元素组成,其中碳元素的质量分数为 。偏二甲肼的相对分子质量为60,试写出其与氧气发生的化学反应方程式 。
23.(12分)将一定质量的NaOH与NaHCO3的固体混合物X,放在密闭容器中充分加热反
应后生成CO2气体Vl(V1不等于0)。将反应后的同体残渣Y与过量的盐酸反应,又
生成CO2V2L,(气体体积均在标准状况下测定)。
(1)Y的成分是______________(填写下列选项的序号)。
A.NaOH 和Na2C03 B.Na2C03和NaHC03 C.NaOH D.Na2CO3
(2)V1与V2的大小关系为___________(填写下列选项的序号)。
A.V1>V2 B.V1<V2 C.Vl=V2 D.无法确定
(3)X中的NaOH和NaHCO3物质的量之比为_______。
(4)Y的质量是__________g。
三、计算题(共18分):
24.(9分)氢气还原氧化铜的反应不完全时,便得到Cu、Cu2O、CuO的固体混合物。化学兴趣小组同学为探究上述固体的成分进行了如下操作和实验:
(1)取一定质量的均匀固体混合物A,将其分成两等份。
(2)取其中—份用足量的氢气还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。(已知Cu2O和CuO都可以被H2还原为Cu,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O).
请回答以下问题:
(1)A中,n(Cu)+n(Cu2O)= 。
(2)A中,n(CuO)的取值范围是 。
(3)试计算所用稀硝酸的物质的量浓度。
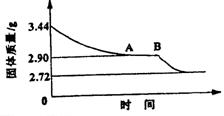
25.(9分)某校课外活动小组为测定生石膏的组成(CaSO4·xH2O),即测定x值,做如下实验:将生石膏放在坩埚中加热,加热前、后都进行称量。随实验次数增加,加热时间不断延长,最后整理加热前后固体质量数据如下表(下右图为根据数据绘制的图象):
| 实验顺序 | 加热前(g) |
| ||
| 1 | 3.44 | 3.26 | ||
| 2 | 3.44 | 3.12 | ||
| 3 | 3.44 | 2.90 | ||
| 4 | 3.44 | 2.90 | ||
| 5 | 3.44 | 2.80 | ||
| 6 | 3.44 | 2.78 | ||
| 7 | 3.44 | 2.72 | ||
| 8 | 3.44 | 2.72 |
(1)利用实验数据,通过计算推断生石膏的化学式。
(2)通过计算解释图象中产生AB段的原因。
(3)若将所得的固体残渣继续升温灼烧,发现质量还会减轻,简述你认为可能的原因。
黄石二中理科实验班复试试题答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | D | C | D | A | B | B | BD | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | B | B | C | C | D | AB | A | A |
21.ACEF 22. 3,40%,C2H8N2+4O2=2CO2+4H2O+N2
23.(12分)(1)D(3分)(2)B(3分)(3)![]() (3分)(3)
(3分)(3)![]() (3分)
(3分)
24. 解:(1) n(Cu)+n(Cu2O)=0.300mol ((2)0.1mol<n(CuO)<0.4mol
(3)设其中一份中n(Cu)= x mol,n(Cu2O)= y mol,n(CuO)= z mol,
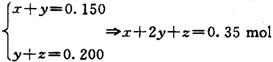
依得失电子守恒和氧元素守恒,有:
亦即反应后生成的硝酸铜的物质的量为0.350mol
则500mL稀硝酸中,n(HNO3)=0.350mol×2+0.100mol=0.800mol
于是:c(HNO3)=0.800mol/0.500L=1.6mol/L
25. (1) CaSO4·xH2O CaSO4 +
xH2O
136+18x 136 18x
3.44 2.72 0.72
x=2 CaSO4·2H2O
|
CaSO4·2H2O CaSO4
· yH2O+(2-y)H2O
172 136+18y
3.44 2.90
![]()
加热过程中生石膏转化成相对稳定的2CaSO4·H2O,所以图象中存在一段时间内质量不变的AB段。
(3)CaSO4受高温灼烧还可以继续分解放出气体。