观桥中学高一化学第六章
硫和硫的化合物 环境保护测试题及答案
一、选择题(每小题3分,共45分):1—10题每小题只有1个选项符合题意,11—15题每小题有1-2个选项符合题意。
1.下列各组物质中,属于同素异形体的是 ( )
A.SO2和SO3 B.H2和D2 C.冰和干冰 D.O2和O3
2.不能说明氯气的非金属性比硫强的是 ( )
A.Cl2与H2光照爆炸,而硫与氢气反应需加热至硫气化
B.Na2S +2HCl=2NaCl+H2S↑ C. HCl比H2S稳定
D.酸性:HClO4>H2SO4
3.0.5mol某单质和8g硫在一定条件下完全反应,该单质可能是 ( )
A.H2 B.O2 C.K D.Mg
4.下列微粒半径大小顺序不正确的是 ( )
A.Cl->Cl>F B.S2->S>Se C.I->Br->Cl- D.Se2->S2->O
5.下列有关氧族元素中硒(Se)的说法中正确的是 ( )
A.在周期表中的位置是第三周期 ⅥA族 B.最高价氧化物的化学式是SeO3
C.非金属性比溴强 D.硒化氢比硫化氢稳定
6.将等物质的量的Cl2和SO2通入水中,充分反应以后,加入紫色石蕊试液和BaCl2溶液,
以下叙述中正确的是 ( )
A.产生BaSO4白色沉淀,溶液变为红色 B.产生BaSO4白色沉淀,溶液变为无色
C.无沉淀生成,溶液变为无色 D.无沉淀生成,溶液变为红色
7.下列气体中,不能用浓硫酸干燥的是 ( )
A.CO B.SO2 C.CO2 D.NH3
8.下列物质中不能用金属单质和非金属单质直接化合制得的是 ( )
A.CuO B.FeC12
C.Cu2S D.FeS
9.80mL稀硫酸与足量氯化钡溶液反应,得到46.6g沉淀,此稀硫酸的浓度是 ( )
A.2.5mol/L B.1.25mol/L C.5mol/L D.3mol/L
10.下列离子方程式书写正确的是 ( )
A.稀硫酸和Ba(OH)2溶液反应 Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.过量的SO2通人 NaOH溶液中 SO2+2OH-=SO32-+H2O
C.铜片在加热条件下与浓硫酸反应 Cu+SO42-+4H+= Cu2++SO2↑+2H2O
D.SO2使溴水褪色 SO2 +Br2 +2H2O =SO42- +2Br- +4H+
11.为了降低硫氧化物造成的污染,一种方法是在含硫燃料中(如煤)加入生石灰,这种方法称作“钙基固硫”采用这种方法“固硫”反应为 ( )
A.2CaO +2S =2CaS +O2↑ B.S+ O2=SO2
C.CaO +SO2= CaSO3 D.2CaSO3 +O2 =2CaSO4
12、向50mL 18mol/L的硫酸中加入足量铜片并加热,被还原的硫酸的物质的量( )
A.小于0.45mol B.大于0.45mol,小于0.9mol
C.等于0.9mol D.等于0.45mol
13、下列反应通入的气体物质在该反应中只作氧化剂的是 ( )
A.二氧化硫通入氢硫酸中 B.氯气通入氢氧化钠溶液中
C.硫化氢通入溴水中 D.少量氯气通入氯化亚铁酸性溶液中
14.下列叙述中正确的是 ( )
A.共价键只存在于共价化合物中 B、离子化合物中不可能存在非极性键
C、单质分子中有一部分存在共价键 D、共价键也存在电子得失
15.设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A. NA个CO分子和NA个N2分子的质量相等 B. 18gD2O含有的电子数为10NA
C. 25℃、1.01×105Pa时,NA个氢分子的体积约是22.4L
D. 同温、同压下,相同体积的氟气和氩气所含的原子数相等
二、填空题(26)
16.(3分)用铁槽车盛装浓硫酸,是利用浓硫酸的 性;将含水蒸气的氯气通过盛浓硫酸的洗气瓶,是利用浓硫酸的 性;除掉铁皮表面的铁锈,是利用浓硫酸的
性。
17. (4分)有 K2SO4、H2SO4、NaOH三瓶未贴标签的溶液,如何只用酚酚一种试剂加以鉴别?
18.(4分)用浓硫酸吸收三氧化硫可得到发烟硫酸(H2SO4·SO3),某化工厂用1.5t质量分数为 98%的浓硫酸吸收三氧化硫制成发烟硫酸,再与水混合可得密度为1.84g/cm3、质量分数为98 %的H2SO4 t。
19.(8分)有一学生取两份A溶液做实验,实验步骤和实验现象如下所示(C不考虑是微溶物)。
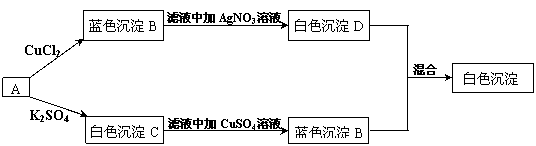
|
|
(1)写出化学式:A. 、B. 、C. 、D. 。
(2)写出下列反应的离子方程式。
![]() A B
A B
![]() A C
A C
20、(7分)、甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余为常见化合物,它们在一定条件下有如下转化关系:(反应中生成的水已略去)
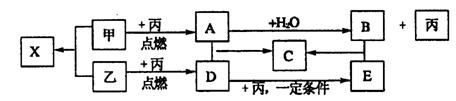
(1)、甲、乙、丙三种单质的名称分别为,甲 乙 丙
(2)、写出下列反应的化学方程式,D+丙→E
A + D → C 。
三、实验题(17分)
21.(11分)实验室有一瓶长久放置的亚硫酸钠,为了检验此瓶亚硫酸钠是否部分被氧化及测定亚硫酸钠的质量分数,有学生设计了下面实验,根据实验步骤填写下列空格。
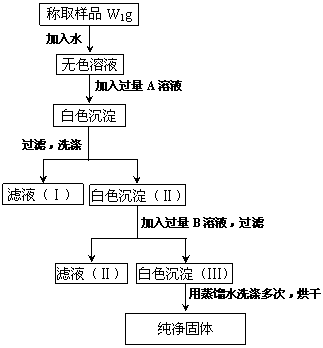
(l)加入的A是 ,应该加入过量的A的理由是
;检验A是否过量的方法是
加入A发生反应的离子方程式是 。
(2)加入的 B是 ,应稍过量的理由是 ;加入B发生反应的离子方程式是 。
(3)为了检验沉淀(Ⅲ)是否洗净,在最后几滴洗涤液中加人 ,
若 ;表示沉淀已经洗净。
(4)含亚硫酸钠的质量分数计算式为 。
(5)当W1与W2的关系式为 时,表明亚硫酸钠已被全部氧化。
22 . ( 6 分)浓硫酸与铜的反应用了下图所示的装置,请回答下列问题。
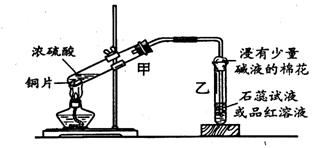
( l )若试管乙中装的是石蕊试液,则反应过程中观察到乙中的现象是 ; 若试管乙中装的是品红溶液,则反应过程中观察到乙中的现象是 。
( 2 )反应结束后在试管甲的底部常可见到一些白色固体,该固体可能是 (填化学式)。待试管甲内液体冷却后,将试管中的液体慢慢倒人另一支盛有少量水的试管中,观察溶液的颜色。这一步操作的目的是要证实 。
( 3 )写出上述试管甲中发生反应的化学方程式
若收集到标准状况下气体 0.56L ,则反应中转移电子的物质的量为
四、计算题(共12分)
23.取一定量的Na2SO4和Na2CO3的混合物溶于水后配成1L溶液,取出100mL,加入足量的氯化钡溶液,滤出沉淀,加入足量的盐酸,沉淀部分溶解且放出标况下的气体1.12L;将剩余沉淀滤出,洗涤,干燥,得沉淀 2.33g,求原溶液中钠离子的物质的量浓度。
24.已知:SO2+2H2S=3S+2H2O,其中氧化产物和还原产物的质量比为2:1。25℃时,向体积为 V L的真空容器内通人 n mol SO2和 m mol H2S。
(1)若n=2,则当m = 时,反应后容器内气体的密度最小。
(2)若2n>m时,则反应后氧化产物和还原产物的质量差为 g。
(3)若 5n=m,且反应后氧化产物和还原产物的质量和为48g时,则 n+ m= 。
参考答案
一、选择题
D B C B B A D B A D CD A AD A A
二、填空题
.16.强氧化; 吸水; 酸.
17.分别取三种溶液少量,加入酚酞,溶液变红的是NaOH,然后把红色溶液分别加到另外两支试管中,红色褪去的是硫酸,无现象的是硫酸钾。
18.3.33
19.(1)A Ba(OH)2 B Cu(OH)2 C BaSO4 D AgCl
(2)Cu2+ +2OH- =Cu(OH)2 ↓ Ba2+ +SO42- =BaSO4↓
20.(1)钠 硫 氧
(2)。2SO2+O2==2SO3 2 Na2O2+2H2O==4NaOH+O2
三、实验题
21.(1)BaCl2溶液 使 SO32- SO42- 沉淀完全 取上层清液少量,再加BaCl2溶 液少量,若无沉淀生成,证明所加BaCl2溶液已过量 Ba2+ +SO32- =BaSO3↓、Ba2+ +SO42- =BaSO4↓ (2)稀盐酸 使BaSO3 全部溶解 BaSO3+2H+ =Ba2+ +SO2↑ +H2O (3)几滴用稀HNO3酸化的AgNO3 溶液 无沉淀产生
![]() (4)
233W1=142W2
(4)
233W1=142W2
22、(1)石蕊试液变红 品红溶液褪色
(2)CuSO4 证明有CuSO4生成
(3)Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O 0.05mol
四计算题
.23. 1.2mol/L 24 .(1)4 (2)16m (3)3