2003-2004学年度下学期
高中学生学科素质训练
高一化学期末考试试卷
时间:90分钟 满分100分
一、选择题(共8小题,每题2分,计16分,每小题只有一个正确答案)
1.在前人科学研究的基础上,归纳总结出元素周期律的科学家是 ( )
A.居里夫人 B.罗蒙诺索夫
C.道尔顿 D.门捷列夫
2.在空气中久置而不易变质的是 ( )
A.烧碱 B.泡花碱 C.纯碱 D.碱石灰
3.为验证浓硫酸与碳反应的气体产物中含SO2和CO2,通常是让气体通过品红溶液,然后
通过KMnO4溶液,最后通过澄清石灰水,在这过程中SO2和CO2表现出的性质是( )
①SO2的漂白性;②SO2的氧化性;③SO2的还原性;④SO2酸性氧化物;⑤CO2酸性氧
化物;⑥CO2的氧化性。
A.①③⑤ B.①②④⑤ C.②③⑤⑥ D.①④⑤⑥
4.下列反应的离子方程式正确的是 ( )
A.澄清石灰水中通入氟化氢:H++OH-== H2O
B.氢氧化钠溶液中通入过量的二氧化硫:SO2+OH-==HSO
C.硫酸铜溶液中加氢氧化钡溶液:Ba2++SO==BaSO4↓
D.溴化亚铁溶液中通入少量氯气:2Fe2++4Br-+3Cl2==2Fe3++2Br2+6Cl-
5.下列实验中浓硫酸表现脱水性的是:①浓硫酸敞口久置于空气中增重;②浓硫酸干燥氢
气;③浓硫酸使白纸变黑;④浓硫酸使蓝色硫酸铜晶体变白;⑤浓硫酸使铁、铝等金属
钝化;⑥蔗糖中加入浓硫酸制“黑面包” ( )
A.②④⑤ B.③④⑤ C.③⑥ D.①③⑤
6.某温度下,在100克水中加入m gCuSO4或加入n g CuSO4·5H2O,均可使溶液恰好达到
饱和,则m与n的关系符合 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
7.下列各组稀溶液不用其他试剂和试纸,就可以将它们区别开的是 ( )
A.硝酸钾 硫酸铜 硫酸氢钠 氯化钡
B.硫酸 硫酸铝 氯化钠 硝酸钠
C.盐酸 硫酸钠 硝酸钠 氢氧化钠
D.硫酸镁 碳酸钠 氢氧化钠 氯化钾
8.下列叙述错误的是 ( )
A.向氢硫酸溶液中加少量过氧化钠产生淡黄色沉淀
B.在反应2FeO+4H2SO4(浓)==Fe2(SO4)3+SO2↑+4H2O中,浓H2SO4既表现出强氧化
性,又表现出酸性
C.Na2SO3溶液蒸干不可得到Na2SO3固体物质
D.浓H2SO4具有强氧化性 ,SO2具有还原性,故不能用浓H2SO4干燥SO2
二、选择题(本题包括10题,每小题3分,共30分,每题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9、硒是一种保健元素,含有硒元素的保健品现已进入市场。硒为第4周期第ⅥA族元素,根据它在元素周期表中的位置推测,硒元素不可能具有的性质是
A.其单质在通常状况下是固体 B.H2Se比HBr稳定
C.SeO3对应的水化物是一种酸 D.常见化合价有-2、+4、+6三种
10、下列化合物中既含有离子键又含有共价键的是
A.HNO3 B.CaCl2 C. NH4Cl D.H2SO4
11、对某酸性溶液(可能含有Br—、SO42—、H2SO3、NH4+)分别进行如下实验;
① 加热时放出的气体可以使品红溶液褪色
② 加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝
③ 加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在原溶液中是否存在的是
A Br— B SO42— C H2SO3 D NH4+
12、下面各组物质中,通入的气体,既作氧化剂又作还原剂的是:
A、Cl2通入石灰水中; B、CO2通入过氧化钠中
C、NO2通入水中; D、SO2通入水中
13、下列变化的实质相似的是:
A. 浓H2SO4和浓HCl在空气中敞口放置时浓度均减小.
B. SO2和Cl2均能使品红溶液褪色.
C.浓H2SO4和稀硫酸与锌反应均生产气体.
D.浓H2SO4、浓HNO3均可以用铁制容器贮存.
14、以NA表示阿伏加德罗常数,下列说法中正确的是
A 标准状况下,11.2L水中含有的分子数为0.5NA
B 1.8g的NH4+离子中含有的电子数为NA
C 常温、常压下,48g臭氧含有的氧原子数为3NA
D 常温、常压下,11.2L氧气所含原子数为NA
15、能正确表示下列化学反应的离子方程式是
A 饱和石灰水跟稀硝酸反应 Ca(OH)2 + 2H+ = Ca2+ + 2H2O
B 氨水和盐酸反应 H++OH-=H2O
C 过量的硫酸氢钠与氢氧化钡溶液反应 Ba2++2OH—+2H++SO42—= BaSO4↓+ 2H2O
D 用大理石与盐酸制取二氧化碳:CaCO3+2H+=Ca2++H2O+CO2↑
16、下列比较中,正确的是
A.离子半径:S2—>Cl—>Na+>Mg2+ B.热稳定性:H2S<H2Se<HCl
C.酸性:HF>HCl>HBr>HI D.氧化性:F2>Cl2> P > S
17、下列有关硼元素的叙述中,正确的是
A.从硼的相对原子量为10.8,可判断硼原子核内的中子数为6
B.在三氯化硼分子中,硼原子最外层满足了8电子结构
C.硼元素可以和氢元素结合成为氢化物
D.硼元素与氢氧根结合的化合物是一种强碱
18、mgCu与足量浓H2SO4完全反应,在标准状况下得到nLSO2,则被还原的H2SO4的量不正确的是( )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
三、填空题:(计42分)
19.(4分)盛硫化氢溶液的试剂瓶的内壁上有一层固体,它是__________,产生的原因是______________________________,洗去该固体的方法是
____________________________________________________________________________________________________。
20.(9分)X、Y、Z三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。试回答:
(1)X离子的结构简图为________________________________________。
(2)工业上由XY2制取XY3的化学方程式为______________________________。
(3)Z2Y对应水化物的碱性比LiOH_______________________________。
(4)Z2Y2的电子式为__________,其中含有__________键和__________键,Z2Y2溶在
水中的反应方程式为_____________________ ____________。
(5)Z2Y属于__________晶体,它与氯水反应的离子方程式为:
__________________________________________________________________。
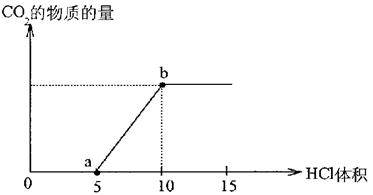
|
(1)写出a点以前发生反应的离子方程式____________________________________;
(2)写出a点到b点发生反应的离子方程式___________________________________。
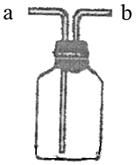
22.(3分)右图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其它用途。
|
呼吸面具之间安装盛有水的该装置,用于观察气
泡产生的情况,以便调节供氧速率,此时氧气应
从___________管口导入。
(2)实验室用MnO2与浓盐酸反应制Cl2的实验中,在
将生成的Cl2直接通入NaOH溶
液之前,先将Cl2从该装置_____________管口导进,
从___________管口导出。此时,该装置所起的作用
是防止NaOH溶液倒流入反应器。
23.(7分)超重元素的假设预言自然界中可能存在114号的稳定同位素X,请根据原子结构
理论和元素周期律预测:
(1)X元素位于周期表中第_______周期,________族,为_______元素(金属或非金属)
(2)写出其最高价氧化物及其水化物的化学式_______________、_____________,并估
计后者为_____________(酸性或碱性)
(3)它与氯气反应生成的化合物的化学式为_________________。
24.(9分)许多元素都存在同位素,同位素在日常生活、工农业生产和科学研究等方面具有很重要的用途,如临床治癌、研究反应机理、核动力发电等。
①国际上一致以碳元素的一种核素—— 原子质量的1/12作为标准来衡量各种原子的相对原子质量。
②据报道,上海某医院正在研究用放射性同位素![]() 治疗肿瘤。该同位素原子核内的中子数是
,该原子的质量是上述碳原子质量的
倍。
治疗肿瘤。该同位素原子核内的中子数是
,该原子的质量是上述碳原子质量的
倍。
③硼元素只有两种天然同位素![]() 和
和![]() ,硼元素的近似相对原子质量为10.8,则天然硼元素中
,硼元素的近似相对原子质量为10.8,则天然硼元素中![]() 的质量分数为
.
的质量分数为
.
④有机化学中常用18O原子作示踪原子来研究乙酸(![]() )与乙醇(
)与乙醇(![]() )反应生成酯(
)反应生成酯(![]() )和水的反应机理,反应过程中酸分子断裂C—O单键,醇分子断裂O—H键。试完成下列反应方程式:
)和水的反应机理,反应过程中酸分子断裂C—O单键,醇分子断裂O—H键。试完成下列反应方程式:
![]() .
.
⑤已知反应: KClO3 + 6HCl = KCl + 3Cl2 + 3H2O ,若用K35ClO3与H37Cl作用,则所得氯气的相对分子质量为 .
25.(6分)长期以来一直认为氟的含氧酸不存在。自1997年美国科学家用F2通过细冰末获
得次氟酸(HFO)以来,对次氟酸的研究引起了充分的重视。
(1)次氟酸的电子式是____________,其中氧元素的化合价为_________
(2)写出制取次氟酸的化学方程式:________________________________________
(3)次氟酸很不稳定,试预测其受热分解的可能途径,用化学方程式表示:
_____________________________________________________________________。
(4)次氟酸能与水反应得到溶液A。A中含有B、C两种溶质;B常用于雕刻玻璃;C
在MnO2催化作用下能迅速分解生成一种使带火星的木条复燃的气体。次氟酸与水
反应的化学方程式是 。
(5)将A溶液滴入紫红色酸性高锰酸钾溶液中,溶液的紫红色逐渐褪去。完成并配平下
列有关反应的离子方程式:
![]() MnO4-+
+
H+
Mn2+ +
+ O2↑
MnO4-+
+
H+
Mn2+ +
+ O2↑
四、计算题:(计12分)
26.(5分)20℃时,向足量的硫酸铜饱和溶液中投入1.6g 无水硫酸铜,然后蒸去10 g水,再恢复到20℃。问最终可析出硫酸铜晶体(CuSO4·5H2O)多少克?(20℃时硫酸铜的溶解度是20g)
27.(7分)密闭容器中将3.62 gNaOH、Na2S、Na2SO3的混合物溶于50 mL某浓度的稀 H2SO4
中,不放出任何气体,再加入100 mL 0.1mol·L-1的Ba(OH)2溶液,正好中和过量的
H2SO4。将反应所得沉淀分离、洗净、烘干、称重,其质量为3.29 g 。求:
(1)原混合物中各物质的物质的量之比;
(2)原稀H2SO4的物质的量浓度。
2003-2004学年度下学期
高中学生学科素质训练
高一化学期末考试试卷答案
难度系数:0.65
一、选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | C | A | B | C | B | A | D | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | B | AC | D | BC | CD | A | C | AD |
三、填空题:
19、S , 2H2S+O2==2H2O+S, ①用热浓NaOH溶液 , ②用CS2溶解
|
|
![]() 20、(1)
(2)2SO2+O2 2SO3 (3)强
20、(1)
(2)2SO2+O2 2SO3 (3)强
|
(4) , 离子 ,非极性共价,2Na2O2+2H2O==4NaOH+O2↑
(5)离子,Cl2+S2-==S↓+2Cl-
21、(1)CO32-+H+==HCO ;(2)HCO+H+==H2O+CO2↑
22、(1)a (2)b , a
23、(1)七, IVA族,金属 (2)XO2、X(OH)4 、 碱性 (3)X+2Cl2==XCl4
24、(1)12C 72 125/72 81.5%
![]() +H2O 73.3
+H2O 73.3
25、(1 ) ,-2 (2)F2+H2O==HFO+HF
![]()
![]() (3)2HFO
2HF↑+O2↑ (4)HFO+H2O
HF+H2O2
(3)2HFO
2HF↑+O2↑ (4)HFO+H2O
HF+H2O2
(5)(2)MnO4-+(5)(H2O2 )+(6)H+ = Mn2+ + (8)(H2O)+(5) O2↑
四、计算题:
26、解:设析出CuSO4·5H2O
为x克 答:略
答:略
27、解:(1)2Na2S+Na2SO3+3H2SO4==3S↓+3Na2SO4+3H2O,
H2SO4+Ba(OH)2==BaSO4↓+3H2O,由题意知:(Na2S) : Na2SO3=2:1
设NaOH为y, Na2S为2x ,Na2SO3为x有:
![]()
∴NaOH:Na2S:Na2SO3=0.020 : 0.02 : 0.01=2 : 2 : 1 (2')
(2)SO42-守恒,最终溶液中为BaSO4:2.33g为0.1mol
Na元素守恒:NaOH:0.02mol, Na2S:0.02mol , Na2SO3 :0.01mol
∴n(Na)=0.02+0.02×2+0.01×2=0.08mol (2')
∴n(Na2SO4)=0.04mol, ∴C(H2SO4)=
![]() = 0.8mol/L (1') 答:略。
= 0.8mol/L (1') 答:略。