单元检测题
一、选择题
1.下列式子中,能表示硫铁矿的主要成分的是( )
A.FeS B.CuFeS2 C.FeS2 D.CaSO4·2H2O
2.有下列气体:①SO2,②H2S,③H2,④HI,⑤CO2,⑥NH3,不能用浓H2SO4干燥的是( )
A.①②④ B.②④⑥ C.①②④⑥ D.①③⑤⑥
3.向含有FeCl3和BaCl2的酸性溶液中通入SO2气体,有沉淀生成,此沉淀是( )
A.BaSO4 B.FeS C.BaSO3 D.S
4.下列实验中没有硫生成的是( )
A.H2S气体通入酸性KMnO4溶液中 B.氢硫酸中滴入少量稀溴水
C.SO2水溶液中通入H2S气体 D.在氧气里充分燃烧H2S气体
5.下列两物质混合后,发生了复分解反应且有沉淀生成的是( )
A.CuSO4溶液和氢硫酸 B.FeCl3溶液和Na2S溶液
C.Pb(Ac)2溶液和硫化钾溶液 D.FeCl2溶液和氢硫酸
6.有一瓶Na2SO3溶液,可能部分被氧化,某同学进行如下实验:取少量此溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入足量稀HCl,充分振荡后仍有白色沉淀,对此实验下 列结论正确的是( )
A.此溶液中na2SO3已部分氧化
B.加入Ba(NO3)2溶液生成的沉淀一定含BaSO4
C.加HC后的不溶沉淀一定为BaSO4
D.不能确定此样品是否被氧化
7.在常温常压下,将a升SO2和b升H2S混合,当反应后气体体积是反应前气体体积的1/4时,则a与b之比是( )
A.1∶1 B.1∶2 C.1∶3 D.3∶1
8.下列反应中,通入的气体物质只作为氧化剂的是( )
A.二氧化硫通入氢硫酸中 B.Cl2通入NaOH溶液中
C.SO2通入NaOH溶液中 D.H2S通入溴水中
9.单质硫与金属单质R在加热条件下可生成化合物M,若把K2S溶液加入到R的硫酸盐溶液中 ,也可得到不溶物M,则R和M可能是( )
A.Al、Al2S3 B.Fe、FeS C.Cu、CuS D.Zn、ZnS
10.将nmol K2SO3和mmol Na2S溶于水,用稀硫酸酸化后,若生成物分别是: ①SO2和S ,②H2S和S,③只有S,则n与m之比值从(Ⅰ)1∶2,(Ⅱ)大于1∶2;(Ⅲ)小于1∶ 2中选出符合上述情况的组合是( )
A.(Ⅰ)(Ⅱ)(Ⅲ) B.(Ⅱ)(Ⅲ)(Ⅰ) C.(Ⅲ)(Ⅱ)(Ⅰ) D.(Ⅱ)(Ⅰ)(Ⅲ)
11.向分别含有下列各组离子的溶液中加入FeBr2晶体,有两种离子的浓度会明显减小的是 ( )
A.K+、OH-、CO2-3 B.Na+、Ag+、NO-3
C.K+、SO2-4、S2- D.H+、Cu2+、NO-3
![]() 12.符合离子方程式S2-+2H+
12.符合离子方程式S2-+2H+ ![]() H2S的化学方程式有( )
H2S的化学方程式有( )
![]()
![]() A.FeS+2HCl FeCl2+H2S B.Na2S+2HNO3
2NaNO3+H2S
A.FeS+2HCl FeCl2+H2S B.Na2S+2HNO3
2NaNO3+H2S
![]()
![]() C.K2S+H2SO4(稀) K2SO4+H2SD.NaHS+HCl NaCl+H2S
C.K2S+H2SO4(稀) K2SO4+H2SD.NaHS+HCl NaCl+H2S
13.下列离子方程式正确的是( )
![]() A.足量H2S通入Fe2(SO4)3溶液中:2Fe3++H2S 2Fe2++S
A.足量H2S通入Fe2(SO4)3溶液中:2Fe3++H2S 2Fe2++S![]() +2H+
+2H+
![]() B.金属钠投入CuSO4溶液中:2Na+Cu2+
Cu+2Na+
B.金属钠投入CuSO4溶液中:2Na+Cu2+
Cu+2Na+
![]() C.向100mL 0.1mol/L的NaOH溶液中通入0.224L(标准状况)CO2;2OH-+CO2
CO2-3+H2O
C.向100mL 0.1mol/L的NaOH溶液中通入0.224L(标准状况)CO2;2OH-+CO2
CO2-3+H2O
![]() D.KH2PO4溶液中加入过量的Ba(OH)2溶液:2H2PO4-+3Ba2++OH-
Ba3(PO4)2+4H2O
D.KH2PO4溶液中加入过量的Ba(OH)2溶液:2H2PO4-+3Ba2++OH-
Ba3(PO4)2+4H2O
14.下列各组离子能大量共存的是( )
A.Na+、Ba2+、S2-、SO2-3 B.H+、K+、HS-、SO2-4
C.Fe2+、H+、Cl-、NO-3 D.K+、NH+4、SO2-4、NO-3
15.120℃时,H2S和O2混合气体充分反应后体积减少30%,则原混合气体中H2S的体积百分含量为( )
A.20% B.40% C.60% D.80%
16.下列除杂方法不正确的是(括号内为杂质)( )
A.H2(H2S)通过CuSO4溶液洗涤
B.SO2(SO3)通过饱和Na2SO3溶液洗涤
C.Na2SO3溶液(Na2SO4)滴加适量的BaCl2溶液
D.Na2SO4溶液(Na2SO3)滴加足量的H2SO4溶液
17.往某溶液中通入过量Cl2无变化,再加入BaCl2溶液和稀盐酸时,产生白色沉淀,该盐可能是( )
A.Na2SO3 B.K2SO4 C.AgNO3 D.Na2CO3
18.取a克铁与足量硫化合生成M,M与过量的盐酸反应生成出气体X;取b克铁与足量的氯气反应生成Y.若X和Y恰好完全作用,则a与b的比值为( )
A.1∶2 B.2∶1 C.3∶2 D.1∶1
19.向含有下列离子的溶液中,分别加入少量的SO3固体后,溶液中离子总数一定增加的是( )
A.HS- B.CO2-3 C.Na+ D.Ba2+
20.在氧气中灼烧0.44克硫铁矿,生成的二氧化硫经过一系列变化最终全部转化为硫酸,用2 0mL 0.5mol/L的烧碱溶液恰好完全中和这些硫酸,则原混合物中硫的百分含量约为( )
A.36% B.46% C.53% D.22%
二、填空题
21.潮湿的氯气和二氧化硫都具有漂白性,将氯气和SO2在相同状况下等体积混合后,其漂白性变化为 ,其原因是 .写出有关反应的化学方程式 .
22.固体A、B都由两种相同元素组成,A、B中两种元素的原子个数比为1∶1和1∶2.将A、B高温煅烧,产物都是固体C和气体D,由D最终可制得强酸E,E的浓溶液和铜片在加热条件下反应生成气体D.E的稀溶液和A反应时,生成气体G和溶液F,G通入D的水溶液中,有浅黄色沉 淀生成.在F中滴入溴水后,加入KOH溶液有红褐色的沉淀生成,该沉淀加热时能转变为C,根据上述事实回答:
(1)A、B的化学式分别为 , .
(2)写出下列反应的化学方程式:
①A煅烧生成C和D ;
②B煅烧生成C和D ;
③G通入D的溶液中 ;
④在F中滴入溴水 ;
(3)写出A和E反应的离子方程式 .
![]()
![]() 23.工业上将硫磺混入Na2SO3溶液中共热至沸可制取Na2S2O3;Na2SO3+S Na2S2O3.制备硫代硫酸钠的另一种方法是:把SO2通入Na2S和Na2CO3的混合溶液中,在反应过程中,先生成黄色沉淀,其量逐渐增多,然后又逐渐减少,当
形成无色透明溶液时,反应完成.
23.工业上将硫磺混入Na2SO3溶液中共热至沸可制取Na2S2O3;Na2SO3+S Na2S2O3.制备硫代硫酸钠的另一种方法是:把SO2通入Na2S和Na2CO3的混合溶液中,在反应过程中,先生成黄色沉淀,其量逐渐增多,然后又逐渐减少,当
形成无色透明溶液时,反应完成.
(1)写出用上述反应制备Na2S2O3的化学方程式:① ,② ,
![]()
![]() ③
,④Na2SO3+S Na2S2O3;
③
,④Na2SO3+S Na2S2O3;
(2)原料中Na2CO3、Na2S和SO2的物质的量之比最好是 ;
(3)若SO2过量,则又会有浅黄色沉淀出现,其原因是(用化学方程式表示) .
三、实验题
![]() 24.已知实验室制取H2S气体的原理是:FeS+H2SO FeSO4+H2S.根据
下图中A~D的实验装置和试剂进行实验,回答下列问题:
24.已知实验室制取H2S气体的原理是:FeS+H2SO FeSO4+H2S.根据
下图中A~D的实验装置和试剂进行实验,回答下列问题:
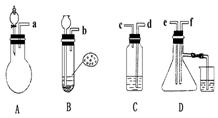 (1)装置A是由双孔塞、玻璃导管及
和
组装起来的.
(1)装置A是由双孔塞、玻璃导管及
和
组装起来的.
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性.
①按实验装置连接顺序,把a![]() f各导管口连接起来,正确的顺序是 ,连 , 连 ;
f各导管口连接起来,正确的顺序是 ,连 , 连 ;
②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
③D中产生的现象是 ,说明SO2具有 性;
(3)A装置中发生反应的化学方程式为 .
(4)烧杯中NaOH溶液的作用 .
25.在25℃时向100ml含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末收集到H21.12L(标况),在此之后又经过4min,铁粉完全溶解 ,则
① 在前2min内用FeCl2表示的平均反应速率是多少?
② 在后4min内用HCl表示的平均反应速率是多少?
③ 在前2min与后4min相比,反应速率哪个较快?为什么?
单元检测参考答案
一、1.C 2.B 3.A 4.D 5.AC 6.CD 7.AC 8.A 9.BD 10.B 11.AD 12.C 1 3.AD 14.D 15.C 16.BC 17.AB 18.A 19.CD 20.A
二、
![]() 21.漂白性消失 Cl2和SO2作用生成了无漂白作用的HCl和H2SO4 2H2O +Cl2+SO2
H2SO4+2HCl
21.漂白性消失 Cl2和SO2作用生成了无漂白作用的HCl和H2SO4 2H2O +Cl2+SO2
H2SO4+2HCl
 22.(1)FeS、FeS2
22.(1)FeS、FeS2
高温
![]() (2)①4FeS+7O2
2Fe2O3+4SO2
(2)①4FeS+7O2
2Fe2O3+4SO2
![]() ②4FeS2+11O2
2Fe2O3+8SO2
②4FeS2+11O2
2Fe2O3+8SO2
![]() ③2H2S+H2SO3
3S+2H2O
③2H2S+H2SO3
3S+2H2O
![]() ④6FeSO4+3Br2
2Fe2(SO4)3+2FeBr3
④6FeSO4+3Br2
2Fe2(SO4)3+2FeBr3
![]() (3)FeS+2H+
Fe2++H2S↑
(3)FeS+2H+
Fe2++H2S↑
![]() 23.(1)SO2+Na2S+H2O Na2SO3+H2S
23.(1)SO2+Na2S+H2O Na2SO3+H2S
![]() SO2+2H2S 3S↓+2H2O
SO2+2H2S 3S↓+2H2O
![]() SO2+Na2CO3
Na2SO3+CO2
SO2+Na2CO3
Na2SO3+CO2
(2)1∶2∶4
![]() (3)Na2S2O3+SO2+H2O 2NaHSO3+S↓
(3)Na2S2O3+SO2+H2O 2NaHSO3+S↓
三、24.(1)分液漏斗、圆底烧瓶
(2)①a、d、c、e、f、b
②溴水或酸性KMnO4溶液 还原性
③瓶壁有浅黄色固体出现 氧化性
![]() (3)Na2SO3+H2SO4
(3)Na2SO3+H2SO4 ![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
(4)吸收未反应的H2S和SO2,以免污染空气
四、25.(1)0.25mol/l·min
(2)0.25mol/l.min
(3)因在同一反应时间里vHCl=2VFeCl2。对比前2min和后4min的速率知,前2min反应速率较快,因前2min时盐酸的浓度较大。