高一第一学期期末化学试卷
第一卷 选择题(占50分)
命题:孔毅英 审题:詹海东
原子量:H-1 N-14 C-12 O-16 S-32 Cl-35.5 Fe-56 F-19 Na-23
Mg-24 Al-27 Cu-64 Zn-65 Mn-55 Ag-108
一、选择题(每小题只有一个正确答案,每小题占2分,本大题共40分)
1、下列物质中不属于化石燃料的是( )
A、煤 B、石油 C、天然气 D、酒精
2、农药波尔多液不能用铁制容器盛放,是因铁能与该农药中的硫酸铜起反应。在该反应中,铁( )
A、是氧化剂 B、是还原剂 C、是催化剂 D、是漂白剂
3、下列离子方程式中,正确的是( )
A、氯化钠溶液与硝酸银溶液反应:Ag+ + Cl- = AgCl↓
B、稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ + H2↑
C、氧化铜与硫酸混合:Cu2+ + SO42— = CuSO4
D、碳酸氢钠与盐酸反应:CO32- + 2H+ = H2O + CO2↑
4、下列各种方法中,可以用于除去苏打中混有的少量小苏打的是( )
A、水洗 B、加热 C、通入CO2 D、加入盐酸
5、下列各组物质中,反应后生成碱和氧气的是( )
A、Na和H2O B、Na2O和H2O C、Na2O2和H2O D、K和H2O
6、1摩硫酸的质量( )
A、98 B、98克 C、98克/摩 D、98摩/克
7、在相同条件下,下列气体中所含分子数目最多的是( )
A、1gH2 B、10gO2 C、30gCl2 D、17gNH3
8、 0.5升1摩/升FeCl3溶液与1.5升1摩/升KCl溶液混合,混合液中Cl-的物质的量浓度(假设混合时溶液的体积不变)( )
A、1摩/升 B、2摩/升 C、1.5摩/升 D、3摩/升
9、要配制0.2摩/升的NaOH溶液1L,需要2mol/L的NaOH溶液的体积是
A、2L B、1L C、0.5L D、0.1L
10、等质量的SO2和SO3( )
A、所含氧原子的个数比为2∶3 B、所含硫原子个数比为1∶1
C、所含硫元素的质量比为5∶4 D、所含原子个数比为3∶4
11、下列元素的原子半径最大的是( )
A、F B、Cl C、Br D、I
12、具有升华性质的物质( )
A、液溴 B、碘 C、石墨 D、氯化钠
13、把淀粉碘化钾溶液滴入下列各物质中,溶液变蓝色的是( )
A、新制的氯水 B、溴化钠溶液 C、食盐水 D、盐酸
14、下列物质暴露在空气中不易变质的是( )
A、漂白粉 B、氢氧化钠 C、溴化银 D、氯化钠
15、在标准状况下,11.2LHCl气体溶于水配成1L溶液,此溶液的物质的量浓度是( )
A、0.5摩/升 B、1摩/升 C、2摩/升 D、4摩/升
16、下列各组离子,在溶液中可以大量共存的是( )
A、Ba2+、Fe2+、OH-、SO42- B、Na+、K+、CO32-、HCO3-
C、NH4+、Ag+、Br-、NO3- D、K+、H+、Cl-、CO32-
17、下列气体:①HCl ②CH4 ③N2 ④Cl2 。其中能被NaOH溶液吸收的是( )
A、①② B、②③ C、①④ D、③④
18、实验室配制一定物质的量浓度溶液时,下列仪器必不可少的是( )
A、容量瓶 B、试管 C、烧瓶 D、量筒
19、把碘从碘水里分离出来,有下列基本操作:①静置后分液 ②充分振荡 ③把碘水倒入分液漏斗,再加入萃取剂四氯化碳。其正确的操作顺序是( )
A、①②③ B、③②① C、②③① D、③①②
20、下列物质中,同时含有氯分子、氯离子和氯的含氧化合物的是( )
A、氯水 B、液氯 C、氯酸钾 D、次氯酸钙
二、选择题(每小题有1个或2个正确答案,每小题占2分,如果2个选项,只选一个,并且正确的给1分,本大题共10分)
21、密度为1.84g/cm3、H2SO4的质量分数为98%的浓硫酸中H2SO4的物质的量浓度是( )
A、18.4mol/L B、18.8mol/L C、18.4mol D、18.8
22、用向上排气法收集氯气时,判断瓶中氯气是否充满可选用( )
A、沾有酚酞的试纸 B、湿润的碘化钾淀粉试纸
C、沾有氢氧化钠浓溶液的试纸 D、观察瓶内气体颜色的变化
23、下列物质不能由单质直接化合而成的是( )
A、NaCl B、HCl C、FeCl2 D、Fe3O4
24、在下列各组物质中,所含分子数相同,原子数也相同的是( )
A、1克氢气和16克氧气 B、1摩氩气和1摩氟气
C、1摩二氧化碳和标准状况下22.4L氨气 D、1摩二氧化碳和34克硫化氢
25、常温常压下,将40L氢气和氧气的混合气体引爆后冷却到原状态时剩余气体4L,则原混合气体中H2的体积可能是( )
A、12L B、16L C、24L D、28L
南海一中2003至2004学年度第一学期高一期末考试题
化学试卷
第二卷 非选择题(占50分)
班别________ 姓名__________学号__________ 成绩__________
原子量: H-1 N-14 C-12 O-16 S-32 Cl-35.5 Fe-56 F-19 Na-23
Mg-24 Al-27 Cu-64 Zn-65 Mn-55 Ag-108
三、填空题(每空1分,共17分)
26、卤族元素包括______、______、______、_______等元素(填元素符号),它们结构的共同点是
___________________,因此在化学反应中一般易_________个电子,变成______离子。
27、按要求用化学式回答:可用于人工降雨的物质是_________;涂于照相感光片上的是_________;
漂白粉的有效成分是______________。
28、把加到红热的铜丝放入氯气瓶中,可观察的现象:_______________________________,再往瓶
中加入少量的水,振荡,溶液呈____色。上述反应的化学方程式:___________________________,
该反应是氧化还原反应,氧化剂是______________,电子转移数目为_________。
29、在9.5克某二价金属的氯化物中含有0.2摩Cl-,此氯化物的摩尔质量为_______________,该
金属元素的相对原子质量为_________________。
四、实验题(每空1分,共15分)
30、重铬酸钾(K2Cr2O7)是一种强氧化剂,重铬酸钾和浓盐酸反应生成氯化钾、三氯化铬、一种气体单质X和水。在下图的装置中,当重铬酸钾与浓盐酸共热时产生的气态单质X经过A、B两瓶后,在C处与加热的白色晶体反应,最后在D瓶底有紫黑色晶体状物质生成。
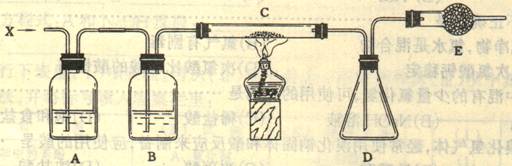
(1)重铬酸钾和浓盐酸反应的反应式(不用配平)_______________________________________
(2)要得到纯净的X气体,A瓶应盛_______________,其作用是_____________________。B瓶
应盛___________________,其作用是___________________。E瓶装置的作用是_____________,
为达到此目的,E装置中应盛放______________________________。
(3)在C处加热可以加快反应的速率,还能___________________,C处反应的化学反应方程式
是_______________________________________________________________________。
31、进行化学实验必须注意安全,下列说法正确的是(填写编号)___________________
A、制取硫化氢(有毒)气体时,必须在通风橱中进行。
B、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在不断搅拌下慢慢加入浓硫酸。
C、做实验时不能用手直接拿取金属钠。
D、让鼻孔靠近集气瓶口闻氯气的气味。
32、实验室是用二氧化锰和浓盐酸反应制氯气,写出该反应的离子方程式_____________________,
如果把干燥的氯气通入干燥的有色布条中,布条_____褪色,多余的氯气要用氢氧化钠溶液吸收,
写出该反应的离子方程式:_________________________________________________________,
指出该反应的还原剂:_________,氧化剂_________。
五、计算题(第33题,每空3分,第34题,每小题4分,本题共18分)
33、400mL某浓度的NaOH溶液恰好与5.6LCl2(标准状况)完全反应,计算:(不用写过程)
(1)生成的NaClO的物质的量__________。 (2)反应物NaOH溶液的物质的量浓度________。
34、4.35克二氧化锰能跟20克质量分数为36.5%的盐酸刚好完全反应,试求:
(1)标准状况下能产生多少升氯气?
(2)有多少摩HCl被氧化?
(3)向反应后的溶液中加入足量的AgNO3溶液,产生多少克沉淀?
参考答案
一、选择题
1、D 2、B 3、A 4、B 5、C 6、B 7、D 8、C 9、D 10、C 11、D 12、B 13、A 14、D 15、A 16、B 17、B 18、A 19、B 20、A
二、选择题
21、A 22、BD 23、C 24、AD 25、CD
三、填空题
26、F、Cl、Br、I;最外层都有7个电子;得到1;阴。
27、AgI,AgBr,Ca(ClO)2
28、有棕黄色的烟,蓝绿,Cu+Cl2 = CuCl2,Cl2,2e-
29、95克/摩,24
30、(1)K2Cr2O7 + HCl— KCl + CrCl3 + Cl2 + H2O
(2)饱和食盐水,吸收氯化氢气体,浓硫酸,吸收水汽,吸收多余气体,碱石灰
(3)使生成的碘变为气体,2KI + Cl2 = 2KCl + I2
31、AC
32、MnO2 + 4H+ + 2Cl- = Mn2+ + 2H2O + Cl2 ,不,Cl2 + 2OH- = Cl- + ClO- + H2O ,Cl2 ,Cl2
33、0.25摩,1.25克/摩
34、(1)1.12升 (2)0.1摩 (3)14.4克