高二化学科下册第一次月考
化学科试题
说明:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间90分钟。
2. 请将全部答案填到答题卷中。
可能用到的相对原子质量: H 1 C 12 O 16 S 32 K 39 Fe 56 Cu 64 Zn 65
第Ⅰ卷 (选择题 共42分)
在下列各题的四个选项中均只有一个是符合题目要求的。
1. 在同温同压下,下列各组热化学方程式中,△H1<△H2的是
A.2H2(g) + O2(g)=2H2O(g);△H1
2H2(g) + O2(g)
= 2H2O(l);△H2
B.S(g) + O2(g)
=SO2(g); △H1
S(s) + O2(g) = SO2(g);△H2
C.CO(g) + 1/2 O2(g)
=CO2(g);△H1 C(g) + O2(g) = CO2(g);△H2
D.1/2 H2(g)
+ 1/2 Cl2(g) = HCl(g);△H1 H2(g)
+Cl2(g)=2HCl(g);△H2
2. 1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol
B.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/mol
D.+(10X-Y) kJ/mol
3. 下列热化学方程式中的反应热表示燃烧热的是
A.C6H12O6(s)+6O2(g)
6CO2(g)+6H2O(l);△H=- akJ·mol-1
B.CH3CH2OH(l)+1/2 O2(g)
CH3CHO(l)+H2O(l);△H=-bkJ·mol-1
C.2CO(g)+ O2(g) 2 CO2(g);△H=-c kJ·mol-1
D.NH3(g)+ 5/4O2(g) NO(g)+
3/2H2O(g);△H=-d kJ·mol-1
4.
强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l); △H=-57.3 kJ·mol-1,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ·mol-1,
1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l)
;△H=-Q2
kJ·mol-1
HNO3(aq)+KOH(aq)= KNO3(aq)+H2O(l);△H=-Q3
kJ·mol-1
则Q1、Q2、Q3的关系正确的是
A.Q1 = Q2 =
Q3
B.Q2 > Q1 >
Q3 C.Q2 >
Q3 > Q1 D.Q2 = Q3 > Q1
5. 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①
Sn(s、白) + 2HCl(aq)=
SnCl2(aq) + H2(g) △H 1
②
Sn(s、灰) + 2HCl(aq)=
SnCl2(aq)+ H2(g) △H 2
③Sn(s、灰)![]() Sn(s、白) △H3=+2.1kJ/mol
Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是
A.△H1 >△H2 B.灰锡转化为白锡的反应是放热反应
C.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
D.锡在常温下以灰锡状态存在
6.
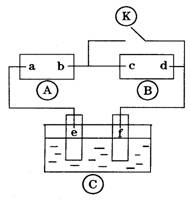 若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是
Cu + 2H+ ===Cu2+ + H2 ↑,则下列关于该装置的有关说法正确的是
A.该装置可能是原电池,也可能是电解池,但电解质溶液必须是酸溶液
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是原电池,且正极不能用锌、铁等比铜活泼的金属
D.该装置只能是电解池,且金属铜为该电解池的阳极
7.
 右图
右图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色。为实现铁上镀锌,接通
上的c点显红色。为实现铁上镀锌,接通![]() 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
8.
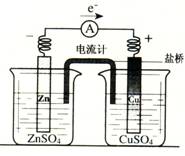
有关如右图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,正确的是
A.反应中,盐桥中的K+会移向ZnSO4溶液
B.工作时,电流计指针偏向铜片
C.取出盐桥后,电流计依然发生偏转
D.反应前后铜片质量不改变
9. 下列有关电化学装置的图示完全正确的是
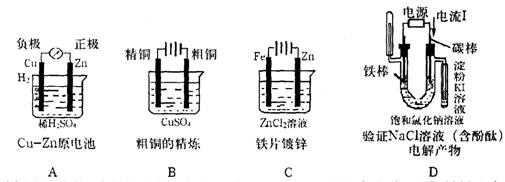
10.
![]()
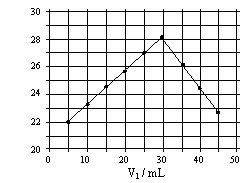 将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
11.
已知蓄电池在充电时作电解池,放电时作原电池;铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”
;关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阴极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阳极,放电时作正极
12.
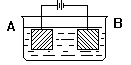 用下图装置进行电解实验:A极是铜锌(均匀)合金,B极为纯铜,电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g。则下列说法不正确的是
用下图装置进行电解实验:A极是铜锌(均匀)合金,B极为纯铜,电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g。则下列说法不正确的是
A.电解实验时阳极反应为 Zn-2e-=== Zn2+ Cu-2e-==Cu2+
B.电解实验时阴极反应为 Cu2++2e-==Cu Zn2++2e-=== Zn
C.电极B上增加的7.68g物质均为铜
D.电极合金中Cu 、Zn原子个数比为3∶1
13.
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是
A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极质量减少与阴极质量增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
14.
用铁片与稀硫酸制取氢气时,要使生成氢气的速率加快,下列措施不能采用的是
A.不用稀硫酸,改用98%浓硫酸 B.不用铁片,改用铁粉
C.滴加少量CuSO4溶液 D.加热
15.
下列说法正确的是
A.能够发生有效碰撞的分子叫做活化分子 B.活化分子的每一次碰撞都能够发生化学反应
C.反应物用量增加后,有效碰撞次数增多,反应速率增大
D.加入催化剂降低了正反应的活化能,增大了逆反应的活化能
16.
下列说法不正确的是
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
17.
一定条件下,可逆反应N2 +3H2![]() 2NH3 △H<0达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3 △H<0达到平衡,当单独改变下述条件后,有关叙述错误的是
A.加催化剂,V(正)、V(逆)都发生变化,且变化的倍数相等
B.加压,V(正)、V(逆)都增大,且V(正)增大的倍数大于V(逆) 增大的倍数
C.降温,V(正)、V(逆) 都减小,且V(正)减小的倍数大于V(逆)减小的倍数
D.恒温、恒压,增大氮气的浓度V(正)增大,但V(逆)减小
18.
下列说法正确的是
A.凡是放热反应都是自发的 B.铁在潮湿空气中生锈是自发过程
C.自发反应都是熵增大的反应 D.电解池的反应是属于自发反应
19.
下列反应中生成物总能量低于反应物总能量的是
A.Ba(OH)2·8H2O+2 NH4Cl===BaCl2+
2NH3+10H2O B.高锰酸钾分解
C.锌放入稀硫酸中 D.碳和水蒸气在高温下反应
20.
以下反应不可以用熵判据来解释的是
A.硝酸铵自发地溶于水
B.CaCO3(s)
== CaO(s)+CO2(g) △H=+175.7kJ/mol
C.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) △H=+74.9kJ/mol
D.2H2(g)+O2(g)==2H2O(l)
△H=-285.8kJ/mol
21.
下列关于铜电极的叙述,正确的是
A.铜锌原电池中铜为负极,发生氧化反应 B.在镀件上电镀铜时,可用精铜作阳极
C.用电解法精炼粗铜时,粗铜作阴极 D.电解稀H2SO4制H2、O2时,用铜作阳极
第Ⅱ卷 (非选择题 共58分)
22.
(3分)对于反应:C(s)+H2O(g)![]() H2(g)+CO(g)在密闭容器中进行,其他条件不变,改变下列哪些条件能加快正反应速率的是
。
H2(g)+CO(g)在密闭容器中进行,其他条件不变,改变下列哪些条件能加快正反应速率的是
。
A.将容器体积缩小一半使压强增大 B.体积不变充入H2O(g)使压强增大
C.体积不变充入He气使压强增大 D.压强不变充入N2使体积增大
E.体积不变升高温度使压强增大 F.增加C的投入量
23. (3分)某反应aA(g)+ b B(g) ![]() cC(g)+d
D(g),取a molA和b molB置于V L容器中,t min后,测得容器内A的浓度为x mo1·L—1,这时B的浓度为
mo1·L—1, C的浓度为
mo1·L—1,这段时间内反应的平均速率若以物质A的浓度变化来表示应为 。
cC(g)+d
D(g),取a molA和b molB置于V L容器中,t min后,测得容器内A的浓度为x mo1·L—1,这时B的浓度为
mo1·L—1, C的浓度为
mo1·L—1,这段时间内反应的平均速率若以物质A的浓度变化来表示应为 。
24.
(2分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0
kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是
。
(2)(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
。
25.
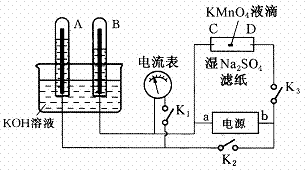 (8分)如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,合闭K2、K3通直流电,回答下列问题:
(8分)如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,合闭K2、K3通直流电,回答下列问题:
(1)判断电源的正、负极:
a为________极,b为________极。
(2)在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象
________ 。
(3)写出电极反应式:
A极____
____,
C极______ _______。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,合闭K1,则电流表的指针是否移动(填是或否)
________。说明理由____________________________。
26.
(11分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
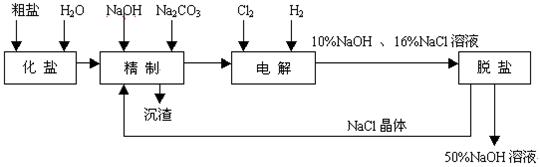
依据上图,完成下列填空:
(1) 在电解过程中,与电源正极相连的电极上所发生反应的化学方程式(电极反应式)为
,与电源负极相连的电极附近,溶液pH值 (选填:不变、升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42—含量较高,必须添加试剂除去SO42—,该试剂可以是 。
a. Ba(OH)2 b. Ba(NO3)2 C. BaCl2
(4)为有效除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为 (填a,b,c)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 、(填操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
27.
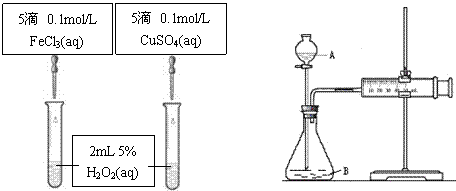 (5分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图A、图B所示的实验。
(5分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图A、图B所示的实验。
(1)图A可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是
,你认为还可以作何改进?
。
图A
图B
(2)检查图B装置气密性的方法是
。
图B所示实验中需测量的数据是
。
28.
 (5分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)
(5分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)
设计的原电池如下左图所示。请回答下列问题:
(1)电极X的材料是
;电解质溶液Y是
;
(2)银电极为电池的
极;X电极上发生的电极反应为
;
(3)盐桥中的阳离子移动的方向是
。
29.
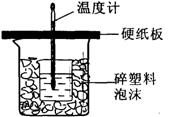 (10分)某同学利用如图所示的装置进行中和热测定的实验,实验步骤如下:
(10分)某同学利用如图所示的装置进行中和热测定的实验,实验步骤如下:
①在大烧杯底部垫碎泡沫塑料,放入小烧杯,再在大、小烧杯之间填上碎纸条,大烧杯上用硬纸板作盖板;
②用一个量筒取50mL2.0 mol·L-1盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,然后把温度计上的酸用水冲洗干净;
③用另一个量筒取50mL2.0 mol·L-1NaOH溶液,并用温度计测量NaOH溶液的温度;
④把套有盖板的温度计放入小烧杯的盐酸中,并将量筒中的NaOH溶液缓缓倒入小烧杯中(注意不要洒在外面),盖好盖板。用温度计轻轻搅动溶液(注意不要碰到烧杯底部或烧杯壁),并迅速读取混合溶液的温度,记为终止温度;
⑤________________________________________________________________________;
⑥根据实验数据计算中和热。
回答下列问题:
(1)请将上面第⑤步的实验步骤补充完整。
(2)从实验装置上看,图中尚缺少的一种玻璃仪器是(量筒除外)__________________。
(3)为保证该实验成功采取了许多措施,其中最主要的作用在于____________________。
(4)在以上①~④步操作或装置图中,有许多不当之处,请指出其中的四处:
Ⅰ
;Ⅱ
;
Ⅲ
;Ⅳ
;(5)用正确的方法测得含有11.2g KOH的稀溶液与1L0.1 mol·L-1的H2SO4溶液反应,放出11.46KJ热量,该反应的中和热化学方程式是__________________________________。
30.
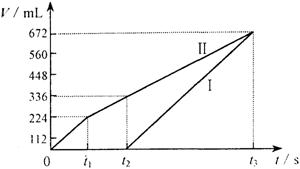 (8分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(8分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的c(H+)。
(3)电解至t3时,消耗水的质量。
化学科参考答案
第Ⅰ卷 (选择题 共42分)
1.B 2.B 3.A 4.C 5.C 6.D 7.B 8.B 9.D 10.B 11.D 12.B
13.D 14.A 15.A 16.C 17.C 18.B 19.C 20.D 21.B
第Ⅱ卷(非选择题 共58分)
22.(3分)ABE
23.(3分) aA(g) + bB(g) ![]() cC(g) + dD(g)
cC(g) + dD(g)
起始浓度: ![]()
![]() 0
0
0
0
1min 后浓度 x
![]()
![]()
![]()
c(B)=
![]() mo1·L—1 c(C)=
mo1·L—1 c(C)=
![]() mo1·L—1
mo1·L—1
υ(A)= ![]() /t mo1·L—1·min—1
/t mo1·L—1·min—1
24.(共5分)391.6 kJ·mol-1 (2分)
(2)CO(g)+FeO(s)= Fe(s) + CO2(g) △H=-218.00 kJ·mol-1(3分)
25.(8分)(1)负、正。(2)紫色向D方向移动,两极有气体产生。
(3)4OH——4e-=2H2O+O2 ↑,4H++4e-=2H2↑。(4)是;组成氢氧燃料电池。
26.(11分)(1) 2Cl――2e-=Cl2 升高
(2)Ca2+ +CO32- = CaCO3↓ Mg2+ +2OH- =Mg(OH)2↓
(3)a c (4)b c (5) 蒸发 过滤
(6)NaCl+H2O![]() H2
+ NaClO
H2
+ NaClO
27.(共5分,每空1分)
(1)反应产生气泡快慢或反应完成的先后(或试管壁的冷热程度)
控制阴离子相同,排除阴离子的干扰
将FeCl3改为Fe2(SO4)3
(2)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 (或其他合理答案)
一定时间内收集到的气体体积或收集一定体积的气体所需要的时间
28.(5分)(1)铜(或Cu) AgNO3溶液 (2)正 Cu-2e- = Cu2+
(3)阳离子从左向右
29.(10分)(1)重复实验两次,取测量所得数据的平均值作为计算依据 (2分);
(2)环形玻璃搅拌器 (1分);(3)减少热损失(1分);
(4)①小烧杯杯口与大烧杯杯口没有相平;②盐酸浓度大了;③NaOH浓度大了;④量筒中的NaOH溶液缓缓倒入小烧杯中;⑤用温度计轻轻搅动溶液;⑥迅速读取混合溶液的温度(或未读取混合溶液的最高温度)。(答出一点给1分,共4分)
(5)KOH(aq) +1/2H2SO4(aq)==1/2K2SO4(aq) + H2O(l) △H=-57.3 kJ·mol-1(2分)
30.(8分)(1)阳极首先逸出的是氯气:
n(NaCl)=2 n(Cl2)=0.02mol 则c(NaCl)=0.1mol/L(2分)
阳极得到336mL气体中,含0.01mol Cl2和0.005molO2
转移电子的物质的量为:0.01mol×2+0.005mol×4=0.04mol
此过程中阴极刚好全部析出铜:
n(CuSO4)=n(Cu)=![]() =0.02mol
=0.02mol
则:c(CuSO4)=![]() =0.1mol/L(2分)
=0.1mol/L(2分)
(2)t2时溶液中c(Na+)=0.1mol/L,c(SO42-)=0.1mol/L
根据电荷守恒有:c(H+)=2×0.1mol/L-0.1mol/L=0.1mol/L(2分)
(3)0.72 g(2分)
