高二化学第一学期期末调研试题
(化学选修)
注意:本试卷分第一部分选择题和第二部分非选择题,共120分,考试时间100分钟。请将第Ⅰ卷的答案填涂在答题卡上,在第II卷上直接作答。考试结束后,请上交答题卡和试卷。
可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Cu—64 Zn—65 I—127
Ba—137
第Ⅰ卷(共48分)
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.减少对化石能源的直接燃烧利用,在解决能源危机中具有重要作用。下列物质不属于化石能源的是
A.氢气 B.煤 C.石油 D.天然气
2.科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2与H2以1︰3的比例混合,在一定条件下完全发生反应,生成某种重要的化工原料和水。该化工原料属于
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
3.增加反应物浓度、增大气体的压强、升高体系温度、使用催化剂都可以加快反应速率,其中活化分子百分数增加的是
①增加反应物浓度 ②增大气体的压强 ③升高体系的温度 ④使用催化剂
A.①② B.②③ C.①④ D.③④
4.25 ℃时,水的电离达到平衡:H2O![]() H++OH- △H>0 ,下列叙述正确的是
H++OH- △H>0 ,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.由水电离出的c(H+)=1×10-12mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH也不变
5.工业生产苯乙烯是利用乙苯的脱氢反应:
![]() △H>0
△H>0
下列说法不正确的是
A.该反应中生成物的总能量高于反应物
B.苯乙烯分子中所有碳原子均采用sp2杂化
C.升高温度可以提高原料乙苯的转化率
D.采用恒容条件生产苯乙烯有利于产率提高
6.常温下,某溶液中由水自身电离产生的H+、OH-,其浓度满足c(H+)·c(OH-)=10-24。该溶液中一定能够大量存在的离子组是
A.Ba2+、Na+、Cl-、NO3- B.Al3+、Ca2+、SO42-、Br-
C.NH4+、K+、HSO3-、CO32- D.Na+、K+、MnO4-、I-
7.如下图所示容器中盛有海水,锌在其中被腐蚀速率最慢的是

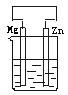
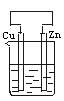
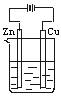
A B C D
8.对于可逆反应:mA(g) + nB(?)![]() xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
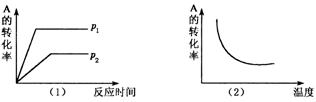
A.△H > 0,m + n > x ,同时B为非气态 B.△H > 0,m + n < x, 同时B为气态
C.△H < 0,m + n > x,同时B为气态 D.△H < 0,m < x ,同时B为非气态
二、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.设NA为阿伏加德罗常数。下列叙述中正确的是
A.1LpH=1的甲酸溶液中,HCOO-和OH-数目之和为0.1NA
B.0.1mol新戊烷与异戊烷的混合物中所含共价键数目为1.6 NA
C.0.1mol碳酸钠溶于水所得溶液中所含阴离子数等于0.1NA
D.标准状况下,11.2L的己烷所含分子数为0.5NA
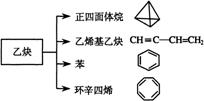 10.乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。下列说法正确的是
10.乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。下列说法正确的是
A.正四面体烷的二氯取代产物有2种
B.正四面体烷与乙烯基乙炔互为同分异构体
C.苯与环辛四烯互为同系物
D.等质量的苯与环辛四烯完全燃烧消耗氧气量相同
11.铅蓄电池在现代生活中有广泛的应用。其电极材料是Pb和PbO2,电解质是稀硫酸。
![]()
下列说法正确的是
A.铅蓄电池使用一段时间后要添加硫酸
B.电池充电时,阴极反应为:Pb-2e-+SO42- PbSO4
C.电池充电时,电池正极应和电源的正极相连接
D.电池放电时,电池正极周围溶液pH不断减小
12.下列溶液中各微粒的浓度关系正确的是
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA—)+c(A2—)
D.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
13.下列实验能取得预期结论或结果的是
A.制备AlCl3晶体:将AlCl3溶液加热、蒸干,并灼烧
B.证明某卤代烃中的碘原子:在卤代烃中滴加NaOH溶液,震荡后滴加AgNO3溶液
C.除去CuSO4溶液中的Fe3+:在溶液中加入氧化铜,调节溶液pH至3~4,过滤
D.证明钢铁发生了吸氧腐蚀:在铁片和铜片间连接检流计,再插入食盐水中
14.某有机物的球棍模型如右图所示,该物质在撞击、摩擦时发生爆炸,被称为熵炸弹。该物质与氧气完全反应产物只有CO2和H2O。由于该上述爆炸反应不是燃烧反应,因此整个过程焓变不大。下列说法正确的是
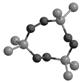 A.该有机物的分子式为C3H6O6
A.该有机物的分子式为C3H6O6
B.该有机物爆炸产物是CO2和H2O
C.上述爆炸过程中一定放出大量的热
D.上述爆炸过程中熵一定显著增加
第二卷(非选择题 共72分)
三、(本题包括1小题,共12分)
15.(12分)重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于酸。通常用饱和Na2CO3溶液处理BaSO4,待达到平衡后移走上层溶液;再加入饱和Na2CO3溶液,重复处理多次,使绝大部分BaSO4转化为BaCO3。
⑴请用简要的文字和方程式分析上述转化的原理
。
⑵某实验小组的同学测定沉淀样品中所含碳酸钡的质量分数,有如下操作:
Ⅰ.准确称取0.250g所得的样品,磨碎后加入少量蒸馏水;
Ⅱ.加入35.00mL0.1mol·L-1 的盐酸,使其充分反应;
Ⅲ.以酚酞为指示剂,用0.1mol·L-1 NaOH溶液滴定滴定至终点;
Ⅳ.重复上述操作2次。
①第Ⅰ步准确称取0.250g样品所使用的仪器是 ;第Ⅱ步操作中加入35.00mL0.1mol·L-1 的盐酸所使用的仪器是 。
②判断滴定达到终点的现象为 。
③下表是该实验的记录结果:
| 滴定 次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.02 | 16.05 |
| 2 | 2.00 | 16.99 |
| 3 | 0.11 | 15.09 |
通过计算,沉淀样品中BaCO3的质量分数为 。
④下列操作使所测碳酸钡的质量分数偏大的是 。
A.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
B.向样品中加盐酸时,有少量盐酸溅出
C.滴定到终点时,滴定管尖嘴悬有液滴
D.读滴定管开始时仰视,终点读数时俯视
四、(本题包括2小题,共24分)
16.(12分)依据氧化还原反应:2Fe3+(aq) + Fe(s) == 3Fe2+(aq),设计原电池并完成如图所示实验。
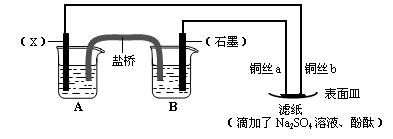
请回答下列问题:
⑴电极X的材料是 ;石墨电极为电池的 极。
⑵B装置中发生的电极反应方程式为 ;表面皿中溶质Na2SO4的作用是 。
⑶铜丝b与滤纸接触处的现象为 ;此处电极反应方程式为: 。
17.(12分)二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
 已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2
已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2![]() 2SO3。
2SO3。
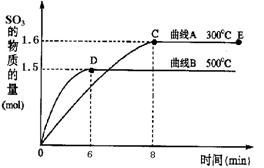
⑴将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如右所示图象,回答下列问题:
①300℃时,平衡常数K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)= 。
③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
⑵工业上制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。可用KMnO4溶液和稀H2SO4测定硫酸尾气中SO2含量,实验时,除需要测定硫酸尾气的流速外,还需要知道或测定的物理量有 、 。
五、(本题包括1小题,共10分)
18.(10分)2007年《中国的能源状况与政策》白皮书指出,中国正在积极着手研究石油、天然气等能源领域的立法。以天然气为原料经过一系列反应可以得到多种产品如下图所示(图中某些转化步骤及生成物未列出)。
回答下列问题:
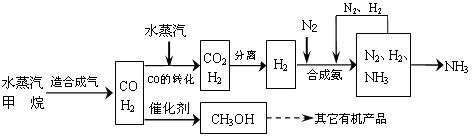
⑴上述合成氨工艺中,循环使用的物质是 ;有人认为:氨的合成反应选择合适的催化剂,可以使合成的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价:
。
⑵用Cu2O做催化剂,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。该反应发生时,催化剂Cu2O与一氧化碳发生了反应,且该反应为可逆反应,写出Cu2O与一氧化碳发生反应的化学方程式
;实验表明,反应体系中含一定量CO2有利于维持反应过程中催化剂Cu2O的物质的量不变,原因是
。
CH3OH(g)。该反应发生时,催化剂Cu2O与一氧化碳发生了反应,且该反应为可逆反应,写出Cu2O与一氧化碳发生反应的化学方程式
;实验表明,反应体系中含一定量CO2有利于维持反应过程中催化剂Cu2O的物质的量不变,原因是
。
⑶已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.31kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
H2O(g)== H2O(l) △H=-40.55kJ/mol
求1mol甲烷与1mol水蒸汽在一定条件下,完全反应生成一氧化碳和氢气(合成气)吸收的热量为 。
六、(本题包括1小题,共18分)
19.(8分)烃A的分子式为C6H12,在一定条件下A与1molHCl加成只能得到C1,A与1molH2加成可以得到烷烃B,B在光照条件下与氯气发生取代反应,只得到两种一氯代烃C1和C2。
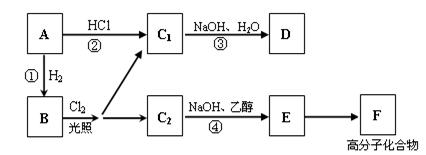
回答下列问题:
⑴A的结构简式为 ;F的结构简式为 。
⑵反应③的化学方程式为: ;
反应④的反应类型为 。
20.(10分)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
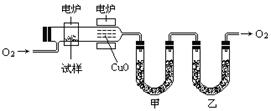 步骤一:这种碳氢化合物蒸汽通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸汽氧化产生7.04g二氧化碳和1.8g水。
步骤一:这种碳氢化合物蒸汽通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸汽氧化产生7.04g二氧化碳和1.8g水。
步骤二:通过仪器分析得知X的相对分子质量为106。
步骤三:用核磁共振仪测出X的核磁共振氢谱有2个峰,其面积之比为2∶3。如下图Ⅰ。
步骤四:利用红外光谱仪测得X分子的红外光谱如下图Ⅱ。
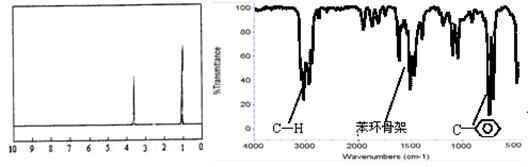
图Ⅰ 图Ⅱ
试填空。
⑴X的分子式为 ;X的名称为 。
⑵步骤二中的仪器分析方法称为 。
⑶写出X与足量浓硝酸和浓硫酸混合物反应的化学方程式:
。
⑷X以醋酸为溶剂在催化剂作用下用氧气可氧化得到另一种重要的化工原料PTA,查阅资料得知PTA的溶解度:25℃时0.25g、 50℃时0.97g、95℃时7.17g。得到的粗产品中有部分不溶性杂质,请简述实验室中提纯PTA的实验方案:
。
七、(本题包括1小题,共8分)
21.(8分)为了测定粗铜的成分,在500 g CuSO4溶液中插入两根电极,一极为精铜,一极为铜锌合金。将铜锌合金与直流电源正极相连、纯铜与直流电源负极相连,通电一段时间后切断电源,立即将电极取出,这时精铜极上增重7.04 g,电解质溶液增重0.02 g。求粗铜中锌的质量分数。
高二化学(选修)期末调研试题
参考答案与评分标准
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.A 2.B 3.D 4.B 5.D 6.A 7.B 8.C
二、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.AB 10.BD 11.C 12.D 13.CD 14.AD
三、(本题包括1小题,共12分)
15.⑴BaSO4溶解在水中的Ba2+能与CO32-结合形成BaCO3沉淀,使BaSO4![]() Ba2++SO42-平衡向正反应方向移动,发生反应BaSO4+CO32-
Ba2++SO42-平衡向正反应方向移动,发生反应BaSO4+CO32-![]() BaCO3+SO42- ⑵①电子天平或分析天平 酸式滴定管 ②最后一滴滴入后,溶液由无色变为红色(粉红色),且30s不变色 ③0.788或78.8% ④BD(每空2分,共12分)
BaCO3+SO42- ⑵①电子天平或分析天平 酸式滴定管 ②最后一滴滴入后,溶液由无色变为红色(粉红色),且30s不变色 ③0.788或78.8% ④BD(每空2分,共12分)
四、(本题包括2小题,共24分)
16.⑴铁 正 ⑵ Fe3++e-==Fe2+ 增强溶液的导电性 ⑶滤纸变为红色 2H++2 e-==H2↑ 或 2H2O+2e-== H2↑ +2OH—(每空2分,共12分)
17.⑴①800 减小 ②0.0125mol·L-1·min-1 ③BC ⑵KMnO4的物质的量 KMnO4溶液褪色的时间(每空2分,共12分)
五、(本题包括1小题,共10分)
18.⑴ H2、N2 催化剂只能提高化学反应速率,不能使化学平衡发生移动
⑵CO+Cu2O![]() CO2+2Cu
对于上述反应,增加CO2的浓度,平衡逆向移动
CO2+2Cu
对于上述反应,增加CO2的浓度,平衡逆向移动
⑶209.55kJ(每空2分,共10分)
六、(本题包括1小题,共18分)
19.⑴![]()
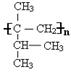
⑵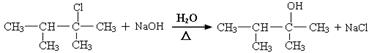 消去反应
消去反应
(每空2分,共10分)
20.⑴C8H10 对二甲苯或1,4—二甲苯 ⑵质谱法
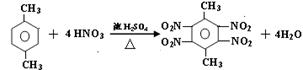 |
⑶
⑷将粗产品溶于适量热水中,趁热过滤,冷却结晶,过滤出晶体 (每空2分,共10分)
七、(本题包括1小题,共8分)
21.解:阴极析出铜的物质的量:n(Cu)=7.04 g/64 g·mol-1=0.11 mol(2分)
铜锌合金溶解的物质的量:n(Cu、Zn) =0.11 mol
“电解质溶液增重0.02 g”相当于发生Zn+Cu2+=Cu+Zn2+反应使溶液增重0.02 g,用差额法计算溶解的锌的物质的量:n(Zn)=0.02 mol(2分)
则溶解的铜的物质的量:n(Cu)=0.11 mol-0.02 mol=0.09 mol。(2分)
w(Zn)=![]() ×100%=18.4% (2分)
×100%=18.4% (2分)
答:粗铜中锌的质量分数为18.4%。
