高二化学第二学期会考统一练习
08.5
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共100分,考试时间90分钟。
第I卷(机读卷 共50分)
| 题号 | 一 | 二 | 三 | 四 |
| 分值 | ||||
| 总分 | ||||
可能用到的相对原子质量:H―1 C―12 N –14 O―16 Na―23 Mg―24 Al―27 S―32 Cl―35.5 Fe—56 Zn— 65 Ba―137
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1.通常情况下极易溶于水的气体是
A.C2H2 B.![]() C.NH3 D.
C.NH3 D.![]()
2.下列化合物中,只存在离子键的是
A.NaOH B.H2O2 C.NaCl D.HCl
3.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为
A.元素 B.单质 C.分子 D.氧化物
4.下列各组物质中,互为同位素的是
A.O2和O3 B.21H和31H
C.CO和CO2 D.C2H6和C4H10
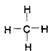 5.下列化学用语错误的是
5.下列化学用语错误的是
![]() A.NaCl的电子式 B.甲烷的结构式
A.NaCl的电子式 B.甲烷的结构式
![]() C.Mg原子结构示意图 D.乙烯的结构简式 CH2=CH2
C.Mg原子结构示意图 D.乙烯的结构简式 CH2=CH2
6.下列烷烃的命名中,正确的是
A.3—甲基丁烷 B.2—乙基丁烷
C.2,3—二甲基丁烷 D.3,4—二甲基丁烷
7.下列化学变化不能一步实现的是
A.Na→Na2O B.A1→A1(OH)3 C.N2→NO D.SO2→SO3
8.下列各组离子在溶液中可大量共存的是
A.NH4+、SO42—、K+、OH- B.H+、Ba2+、NO3—、SO42—
C.K+、Cl-、CO32—、Na+ D.K+、OH—、Na+、HCO3—
9.下列物质中,不能与水发生反应的是
A.SiO2 D.NO2
C.Na2O2 D.CaO
 10.北京奥运会“祥云”火炬使用的燃料为丙烷。下列关于丙烷的说法正确的是
10.北京奥运会“祥云”火炬使用的燃料为丙烷。下列关于丙烷的说法正确的是
A.常温常压下为液体
B.与丁烷互为同分异构体
C.能使酸性高锰酸钾溶液褪色
D.1mol丙烷完全燃烧需5mol氧气
11.下列化学反应属于吸热反应的是
A.氢氧化钠溶液和盐酸反应 B.浓硫酸溶于水
C.镁与稀盐酸反应 D.氢氧化钡晶体与氯化铵混合
12.下列离子方程式中正确的是
A. 铁与稀盐酸反应:Fe + 2H+ ══ Fe3+ + H2↑
B.氯气与H2O反应:Cl2+H2O══2H++Cl-+ClO-
C.钠与水反应:2Na+2H2O══2Na++2OH-+H2↑
D.向硫酸铜溶液中加入过量的氢氧化钡溶液:Ba2++SO42-══BaSO4↓
 13.如右图所示的装置,下列说法正确的是
13.如右图所示的装置,下列说法正确的是
A.电子从铜片上流出 B.铜片上产生气泡
C.负极上发生了还原反应 D.锌片是原电池的正极
14.下列说法错误的是
A.催化剂可以改变化学反应速率
B.食物放在冰箱中会减慢食物变质的速率
C.2mol SO2与 1mol O2混合一定能生成2mol SO3
D.锌与稀硫酸反应时,加入少量铜粉能加快产生氢气的速率
15.下列说法中,正确的是
A.用氢氧化钠溶液清洗沾在皮肤上的苯酚 B.用浓硫酸吸收氨气中的水分
C.用稀硝酸洗去残留在试管内壁上的银 D.用酒精萃取碘水中的碘
16.下列实验操作中,正确的是
A.用托盘天平称量药品时,左盘放药品,右盘放砝码
B.向试管中滴加试剂时,将滴管下端紧靠试管内壁
C.烧瓶和烧杯置于酒精灯上直接加热
D.使用试纸检验溶液的性质时,将试纸浸入溶液中
17.对于反应MnO2 + 4HCl(浓) ![]() MnCl2 + Cl 2↑+
2H2O ,下列说法不正确的是
MnCl2 + Cl 2↑+
2H2O ,下列说法不正确的是
A.该反应是氧化还原反应
B.MnO2是氧化剂
C.Cl 2是氧化产物
D.若生成7.1 g Cl 2,则转移0.1 mol电子
18.某化合物的性质如下:①将少量此化合物加入到适量氢氧化钠溶液中,加热,产生使湿润的红色石蕊试纸变蓝的气体;②将少量此化合物溶于水,加入硝酸钡溶液,产生能溶于稀硝酸的白色沉淀。则该物质是
A.NH4Cl B.(NH4)2CO3
C.NaCl D.K2SO4
19.1868年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
A.N、Mg、Si、P都是第3周期元素 B.F、Cl、Br、I都是VIIA的元素
C.IA族的元素全部是金属元素 D.短周期是指第一、二、三、四周期
20.a、b、c、d四种金属,将a和b用导线连接起来,浸入电解质溶液中,b不易腐蚀;
将a、d分别放入等浓度盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液中无明显变化;
如果把Cu浸入c的盐溶液中,有金属c析出。则这四种金属的活动顺序为:
A.d>c>a>b B.d>a>b>c C.d>b>a>c D.b>a>d>c
21.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为: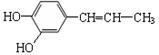
下列关于咖啡酸的说法中,正确的是
A.属于芳香烃 B.分子式为C9H7O2
C.不能使酸性KMnO4溶液褪色 D.能与浓溴水发生取代和加成反应
22.下列除杂质选用的试剂和主要操作都正确的是
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | CaCO3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| C | Fe | Al | 氢氧化钠 | 分液 |
| D | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
23.下列叙述不正确的是
A.原子半径:H<Al<Mg<Na
B.热稳定性:HCl>H2S>PH3>AsH3
C.N、O、F三元素非金属性依次减弱
D.P、S、Cl三元素最高价氧化物对应的水化物酸性依次增强
24.能鉴别CCl4、 、CH3CH2OH、AgNO3、NaOH、KI六种溶液的一种试剂是
A.MgCl2溶液 B.盐酸 C.FeCl3溶液 D.Ba(OH)2 溶液
25.下列各反应达到化学平衡后,增大压强或降低温度,都能使化学平衡向正反应方向移动的是
A.C(s)+CO2(g)![]() 2CO(g)
(正反应为吸热反应)
2CO(g)
(正反应为吸热反应)
B.3O2(g)![]() 2O3(g)
(正反应为吸热反应)
2O3(g)
(正反应为吸热反应)
C.CO(g)+NO2(g)![]() CO2(g)+NO(g) (正反应为放热反应)
CO2(g)+NO(g) (正反应为放热反应)
D.N2(g)+3H2(g)![]() 2NH3(g) (正反应为放热反应)
2NH3(g) (正反应为放热反应)
第II卷 (非选择题 共50分)
二、填空题(本题包括5小题,共29分)
1.(6分)在3517Cl原子中含有 个质子, 个中子;它的原子结构示意图为 。铁在氯气中燃烧,生成 (填化学式),在这个反应中,氯气是 剂(填“氧化”或“还原”)。在此反应中,每转移1.5mol电子,消耗的铁是 g。
2.(5分)钠、铝和铁是三种重要的金属。请回答:
(1)三种金属中,常温下遇浓硫酸或浓硝酸不会发生钝化现象的是 (填化学式);三种金属中,某种金属的氢氧化物M 既能与强酸反应,又能与强碱溶液反应,请写出M与强碱溶液反应的离子方程式 。
(2)三种金属在一定条件下均能与水发生反应。其中铁与水蒸气在高温下反应的化学方程式为 ;钠与水反应时可观察到的实验现象有____________ (填字母)。
a.钠浮在水面上 b.钠熔成小球 c.钠四处游动 d. 溶液变为红色
3.(5分)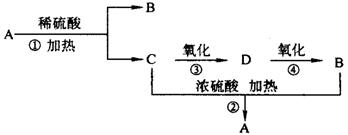 化合物A是一种酯,它的分子式为C4H8O2,有下图转化关系。试回答下列问题。
化合物A是一种酯,它的分子式为C4H8O2,有下图转化关系。试回答下列问题。
(1)A的名称是 。
(2)B的结构简式是 。
(3)D中含有的官能团是 (填名称)。
(4)写出B和C反应生成A的化学方程式 。
4.(7分)某同学为探究碳酸钠的性质,进行了如下实验,请你按要求回答有关问题。
(1)配制100 mL 0.5 mol/L的Na2CO3溶液。该同学用天平称量Na2CO3固体的质量为 g。在配制该溶液时,需要用到的玻璃仪器有 、 、 和 。
(2)用pH试纸检测所配溶液的pH,pH>7,说明Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”);用试管取少量所配溶液,向溶液中滴加几滴酚酞试液,溶液变红,再用酒精灯加热,溶液的颜色变深,说明升高温度,对Na2CO3的水解有 作用。
5.(6分)已知A是黑色固体(常作燃料),B为常见的强酸,C和F是无色气体,D是红棕色气体,转化关系如下:
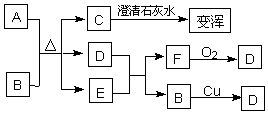
(1)请写出C的电子式 ,F的分子式 。
(2)请写出A和B反应的化学方程式: 。
(3)请写出D和E反应的离子方程式: 。
三、实验题(本题包括3小题,共13分)
6.(3分)有下图所示的A、B、C、D、E五种仪器,请选择仪器的编号完成下列填空。
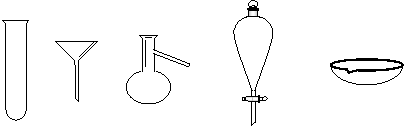 |
A B C D E
(1)可用酒精灯直接加热的有______________。
(2)分馏石油需用_____________。
(3)分离汽油和水的混合物需用____________。
7.(4分)为测定由CO、![]() 、
、![]() 、
、![]() 组成的混合气体中各成分的体积分数,请用下列装置设计一个简单实验(装置不能重复使用,所用试剂均过量)。
组成的混合气体中各成分的体积分数,请用下列装置设计一个简单实验(装置不能重复使用,所用试剂均过量)。

![]() 已知存在下列反应:2NH3 + 3CuO 3Cu + N2
+ 3H2O
已知存在下列反应:2NH3 + 3CuO 3Cu + N2
+ 3H2O
请回答:
(1)混合气体通过各装置的顺序依次是( )→(①)→( )→( );
(2)写出装置③中有关反应的离子方程式_________ _________;
(3)装置③和④的位置不可互换,其原因是_______________ _________。
8.(6分)为分析某地区的空气质量状况,某校化学研究性学习小组的同学拟测定该地区空气中SO2的含量(假设分析过程中涉及的气体体积均为标况下气体体积)。
⑴ 检验SO2可选用 试液。
⑵ SO2与酸性KMnO4溶液反应的离子方程式为:
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。该反应的现象是 ,
SO2在该反应中体现 (填“氧化”或“还原”)性。
⑶ 该小组的同学拟用下列装置运用“⑵”中的反应原理定量分析空气中SO2的含量:

① 装置中棉花的作用是 ,
通入空气前应进行的实验操作是 ;
② 该实验中需要知道的数据除气体流速、酸性KMnO4溶液的体积外还有 。
四、计算题(本题包括2小题,共8分)
9.(4分)将11.2L氢气和14.2g氯气混合,使其在光照条件下充分反应,并将生成的氯化氢全部溶于水制成250mL溶液。试计算(气体体积均在标准状况下测定):
(1)生成氯化氢的体积。
(2)所得溶液的物质的量浓度。
10.(4分)有铁和三氧化二铁组成的粉末状混合物19.2g,向其中加入250mL未知浓度的稀硫酸,当固体全部溶解时,放出3.36L氢气(标准状况)。经测定,反应后的溶液中C(H+)为1.6mol/L,且溶液中不含三价铁离子,求:(l)混合物中铁和三氧化二铁的质量各为多少克?(2)所加稀硫酸的物质的量浓度是多少?(要求写出详细的解题过程)
崇文区2007―2008学年度第二学期高二会考统一练习化学参考答案:
一.选择题(共50分):
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | C | A | B | C | C | B | C | A | D | D | C | B |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | C | C | A | D | B | B | B | D | A | C | C | D |
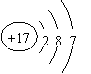 二.填空题(共29分):
二.填空题(共29分):
1. (6分) 17 18 FeCl3 氧化 28
2.(5分)(1)Na Al(OH)3 + OH- =AlO2- + 2H2O
(2)3Fe + 4H2O(g)
![]() Fe3O4 + 4H2↑(2分) ;abc
Fe3O4 + 4H2↑(2分) ;abc
3.(5分,方程式2分)(1) 乙酸乙酯 (2) CH3COOH
(3)醛基 (4) CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
4.(7分)(1)5.3 100mL容量瓶、烧杯、玻璃棒、胶头滴管(2)碱性 促进
5.(6分,方程式2分)
![]() (1)
,NO
(1)
,NO
(2) C + 4HNO3(浓) ![]() CO2↑+ 4NO2↑+ 2H2O
CO2↑+ 4NO2↑+ 2H2O
(3) 3NO2 + H2O = 2H+ + 2NO3—+ NO
三.实验题(共13分)
6.(3分)(1)A、E(2)C(3)D
7.(4分,方程式2分)(1)④①②③
(2)CO2+Ba2++2OH- = BaCO3↓+H2O
(3)会造成![]() 体积测定时的巨大误差(合理答案给分)
体积测定时的巨大误差(合理答案给分)
8.(6分,每空1分)⑴ 品红 ⑵ 紫色溶液褪色 还原
⑶ ① 防止固体颗粒进入KMnO4溶液 检查装置的气密性 ② 酸性KMnO4溶液的物质的量浓度
四.计算题(共8分 )
9.(4分)(1) 8.96L(2分)(2)1.6 mol/L(2分)
10.(4分)
(1) Fe:11.2g Fe2O3:8g (2分) (2)2 mol/L(2分)