高二化学期中考试试题(理科)
说明:
1、本试试分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共37题。
2、答卷时间:100分钟 满分:120分
3、第Ⅰ卷用2B铅笔涂在答题卡上,第Ⅱ卷答案用蓝色钢笔或圆珠笔填在第Ⅱ卷答题纸上。考试结束后,只交第Ⅰ卷答题卡和第Ⅱ卷答题纸。答案写在试题卷上无效。
4、可能用到的相对原子质量 C---12 H---1 O---16 Cu---64 Na---23
第Ⅰ卷(共60分)
一、选择题(本题共30小题,每小题2分,共60分。每小题有1~2个选项符合题意)
1.“纯净水”、“太空水”、“蒸馏水”等商品作为日常饮料水,因缺少某些成分而不利于少年儿童身体健康,你认为在制各上述商品饮料水时至少还需要添加微量的化学物质是( )。
A.钙和镁的碳酸氢盐 B.含碘酸盐的食盐
C.漂白粉等消毒剂 D.小苏打
2.下列四组物质间的反应,其中与其他三个有本质不同的是( )
A.C12+H2O→ B.NO2+H2O→ C.F2+H2O→ D. Na2O2+H2O→
3.NA代表阿伏加德罗常数,以下说法正确的是( )
A.12lg CCl2F2所含的氯原子数为2NA
B.常温常压下l mol NO2气体与水反应生成NA个NO3一 离子
C.氯化氢气体的摩尔质量等于NA个氯气分子和NA 个氢分子的质量之和
D.124g Na2O溶于水后所得溶液中含有O2-离子数为2NA
4.元素周期表中第七周期为不完全周期,若将来的发现把第七周期全排满,则下列推论可能错误的是( )
A.第七周期元素都是放射性元素
B.该周期原子序数最大的元素单质一定不与任何物质反应
C.该周期0族元素的原子序数为118
D.该周期ⅢA族元素的氢氧化物性质与Al(OH)3不同
5.下列各种变化中,不属于化学变化的是( )。
A.向鸡蛋白溶液中滴入饱和硫酸铵溶液,析出白色沉淀
B.加热胆矾得到白色的无水硫酸铜粉末
C.向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体
D.向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉淀
6.某学生做完实验后,采用以下方法分别清洗所用仪器:①用稀HNO3清洗做过银镜反应的试管;②用酒精清洗做过碘升华的烧杯;③用浓盐酸清洗做过高锰酸钾分解实验的试管;④用盐酸清洗长期存放过氯化铁溶液的试剂瓶;⑤用氢氧化钠溶液清洗盛过苯酚的试管。你认为他的操作( )
A.②不对 B.③、④不对 C.④⑤不对 D.全部正确
7.相对分子质量为100的烷烃,主链上有5个碳原子的同分异构体有( )。
A.3种 B.4种 C.5种 D.6种
8. 实验中发生如下事故,处理方法正确的是( )。
A.浓H2SO4溅皮肤上,用NaOH溶液中和。
B.酒精洒在桌面上引起失火,可用水浇灭。
C.苯酚粘在手上可用NaOH溶液洗去。
D.在实验中不慎将手划破,应立即用浓FeCl3溶液止血。
9.光照对下列反应几乎没有影响的是:( )
A.氯气跟氢气反应 B.氯气跟甲烷反应
C.乙烯跟氧气反应 D.次氯酸分解
10.等质量的乙烯和聚乙烯完全燃烧所消耗氧气的物质的量,前者和后者的关系是( )
![]()
![]() A.前者大
B.后者大 C.相等
D.不能确定
A.前者大
B.后者大 C.相等
D.不能确定
11.1mol HO— —COO— —OH与足量的氢氧化钠溶液混合共热,充分反应后最多可消耗氢氧化钠的物质的量为( )。
A.2mol B.3mol C.4mol D.5mol
12.使9g草酸和某二元醇完全酯化,生成环状酯Wg和水3.6g,则该醇的相对分子质量可以表示为( )。
A. ![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.下列离子方程式正确的是( )
A.氯气通入水中:
![]() Cl2+H2O
2H++Cl-+ClO-
Cl2+H2O
2H++Cl-+ClO-
B.向偏铝酸钠溶液中通入过量的CO2气体:
![]() A1O2-+2H2O+CO2 Al(OH)3↓+HCO3-
A1O2-+2H2O+CO2 Al(OH)3↓+HCO3-
C.加热浓盐酸和二氧化锰的混合物:
![]() MnO2+4H++4CI- Mn2++2H2O+2C12↑
MnO2+4H++4CI- Mn2++2H2O+2C12↑
D.向澄清石灰水中加入少量NaHCO3:
![]() Ca2++OH-+HCO3- CaCO3↓+H2O
Ca2++OH-+HCO3- CaCO3↓+H2O
14.在密闭容器中发生如下反应:mA(气)+nB(气)![]() pC(气),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2;当达到新平衡时,C的浓度为原来的1.9倍,下列说法错误的是( )。
pC(气),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2;当达到新平衡时,C的浓度为原来的1.9倍,下列说法错误的是( )。
A.m+n>p B.A的转化率降低
C.平衡向逆反应方向移动 D.C的体积分数增加
15.实验室将NaClO3和Na2SO3按分子个数比为2:1倒入烧瓶中,同时滴入适量硫酸,并用水浴加热,产生棕黄色的气体x,反应后测得NaClO3和Na2SO3恰好完全反应,则x为( )
A. C12 B.C12O C. C1O2 D.C12O3
16.我国首创的铝-空气-海水电池被称为“海洋电池”,是一种无污染的长效电池,以铁铂合金网(接触空气)和铝分别为电池的两极放入海水中即可供电,下列反应与该电池的工作原理有关的是( )
![]()
![]()
![]() ①Fe-2e- Fe2+ ②Al-3e- A13+
③O2+2H2O+4e- 4OH-
①Fe-2e- Fe2+ ②Al-3e- A13+
③O2+2H2O+4e- 4OH-
![]()
![]() ③4AI+3O2+6H2O 4A1(OH)3 ④2Fe+O2+2H2O 2Fe(OH)2
③4AI+3O2+6H2O 4A1(OH)3 ④2Fe+O2+2H2O 2Fe(OH)2
A.②③④ B.①③⑤ C.①⑤ D.③④
17.一些治感冒的药含有PPA的成分,PPA对感冒有较好的对症疗效,但也有较大的副作用。2000年11月,我国药监局紧急通知,停止使用含有PPA成分的感冒药。PPA是盐酸苯 丙醇胺(pheny propanolamine)的缩写。从其名称看,它的分子结构中不含下列基团中的( )
A. -OH B.-COOH C.-C6H5 D.-NH2
18.有含C、H、O三种元素的有机物完全燃烧时生成的二氧化碳与消耗的氧气的物质的量之比为4:5,并知分子中氧原子与氢原子的物质的量之比小于1:2,则该有机物可能是( )
A. CH3OH B.CH3CH2OH C.HO-CH2-CH2-OH D.HCHO
19.下列各组离子在酸性条件下能大量共存且溶液无色的是( )
A.Mg2+、NO3-、Na+、SO42- B.Cu2+、NO3-、SO42-、 H+
C.A1O2-、S2-、Na+、NH4+ D. A13+、Na+、NH4+、NO3-
20.下列物质中,既能使溴水褪色,又能产生沉淀的是( )。
A.丁烯 B.乙醇 C.苯酚 D.氢硫酸
21.下列物质中,既能发生氧化反应,又能发生还原反应的是( )。
A.葡萄糖 B.乙酸乙脂 C.2—甲基丙醇 D.丙醛
22.下列物质中,在水解前和水解后的溶液中都能发生银镜反应的是( )。
A.蔗糖 B.麦芽糖 C.甲酸乙酯 D.乙酸甲酯
23.环境污染已成为人类社会面临的重大威胁,各种污染数不胜数。下列名词与环境污染无关的是( )
①温室效应②赤潮③酸雨④光化学污染⑤臭氧空洞⑥潮汐⑦大脖子病⑧富营养化
A.②⑥ B.⑥⑦ C.①③⑤ D.④⑤⑧
24.不用其它试剂,仅用试管无法鉴别组内两种溶液的是( )
A.ACl3、NaOH B.AgNO3、NH3·H2O
C.NaAlO2、HNO3 D.AgNO3、NaCl
25.下列物质中,不能用于消毒或净化饮用水的是( )
A.氯化铁 B.氯气 C.明矾 D.福尔马林
26.以下实验操作中能达到预期目的是( )
A.用滴入氯化钙溶液的方法来鉴别KHCO3和K2CO3溶液
B.不断地加热SnCl2溶液直至蒸干可得到SnCl2晶体
C.乙炔中混有H2S和PH3等杂质,将气体通过盛有CuSO4或AgNO3溶液的试剂瓶中即可除去杂质
D.用pH试纸可测定浓硝酸或浓硫酸的pH
27.某人设计了4种制备气体的方案:①加热稀硫酸和乙醇制备乙烯;②加热稀盐酸和二氧化锰制备氯气;③用稀硫酸和大理石制备二氧化碳;④用稀硝酸和硫化亚铁制备硫化氢。你认为不宜采用的方案是( )
A.只有①和③ B.只有②和③ C.只有③和④ D.①②③④
28.为提纯下列物质(括号内为杂质),所选用的除杂试剂与分离方法都正确的是( )
| 不纯物 | 除杂试剂 | 分离方法 | |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | Br2水 | 分液 |
29.在CaCO3悬浊液中存在着如下平衡:CaCO3(固)![]() Ca2+
+ CO32-,欲使悬浊液中固体的量减少,可采取的措施是( )
Ca2+
+ CO32-,欲使悬浊液中固体的量减少,可采取的措施是( )
A.加Na2CO3溶液 B.通入CO2气体 C.加氯水 D.加Ca(HCO3)2溶液
30.某溶液中已电离的水是10×-13mol/L。此溶液中肯定能共存的离子组是( )
A.K+、Na+、NO3-、SO42- B.Mg2+、K+、NO3-、Cl-
C.Na+、Fe2+、NO3-、Cl- D.Na+、NH4+、Cl-、SO42-
第Ⅱ卷(共60分)
二、填空题(共2小题,共12分)
31.(6分)由C、H、O三种元素组成的有机物A 6g,跟足量的金属钠反应,生成0.05mol氢气,该有机物蒸气的密度是相同状况下乙烷气体密度的2倍,则该有机物的结构简式可能是 、 、 。
32.(共6分)(1)在常温的条件下某硫酸和硫酸铝两溶液的pH值都是3,那么硫酸中水电离出的[H+]是硫酸铝溶液中水电离出的[H+]的 倍。
(2)537℃,1.01×105Pa时,往容积可变的密闭容器中充入2molSO2,lmolO2, 此时容器的体积为200L。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:2SO2(g)+O2(g)
![]() 2SO3(g)达到平衡时,平衡气体中SO3的体积分数为0.91。保持上述温度的压强不变,若向容器中只充入2mol SO3并加入固体催化剂,则平衡时,SO2的体积分数是
,容器的体积为
L
2SO3(g)达到平衡时,平衡气体中SO3的体积分数为0.91。保持上述温度的压强不变,若向容器中只充入2mol SO3并加入固体催化剂,则平衡时,SO2的体积分数是
,容器的体积为
L
三、推断题(共2题,共16分)
33.(共5分)甲、乙、丙均为中学化学常见气体单质,A、B、C为常见的化合物。可供参
考的信息有:(I)A和B都极易溶于水,用两根玻璃棒分别蘸A和B的浓溶液后相互靠近,会看到白烟。
(II)甲与乙在一定条件下反应的有关数据为:
| 项目 | 甲 | 乙 | A |
| 起始时 | 3mol/L | 3mol/L | |
| 2s末 | 1.8mol/L | 2.6mol/L | 0.8mol/L |
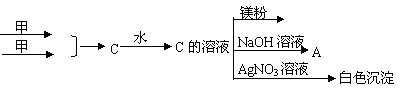
乙 A
丙 B
分析上述信息回答下列问题:
(1)丙的电子式为:
(2)用A、B、C的化学式填空:水溶液呈酸性的是 。
(3)甲与乙反应生成A的速率为:v(甲)= 。
(4)写出C与NaOH溶液反应生成A的离子方程式。
34.(11分)已知① ![]()
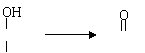 ② 同一碳原子上有多个羟基不稳定且自动脱水,
② 同一碳原子上有多个羟基不稳定且自动脱水,
如—C—OH —C— + H2O
某碳氢化合物A(C9H8),分子有苯环和一个侧链,A能发生下列一系列反应:
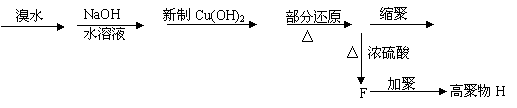 |
A B C D E 高聚物G
(1) 写出下列物质的结构简式
A B
E F
G H
(2)E→F的反应类型
四、合成题(共12分)
35.(12分)从丙烯全成硝化甘油(三硝甘油酯)可采用下列四步反应:
![]()
![]()
![]()
![]() 丙烯 ① ② 1,2,3—三氯丙烷(ClCH2CHClCH2Cl) ③ ④ 硝化甘油。
丙烯 ① ② 1,2,3—三氯丙烷(ClCH2CHClCH2Cl) ③ ④ 硝化甘油。
![]() 乙知:CH2
乙知:CH2 ![]() CHCH3+Cl CCl4 ClCH2CHClCH3
CHCH3+Cl CCl4 ClCH2CHClCH3
![]() CH3CH
CH3CH ![]() CH2+Cl2 500℃ CH2
CH2+Cl2 500℃ CH2 ![]() CHCH2Cl+HCl
CHCH2Cl+HCl
写出①②③④各步反应的化学方程式,并分别注明反应类型
五、计算题(共20分)
36.(10分)有A、B两种均由C、H、O组成的有机物,这3种元素的质量比均为6:1:4。已知2.75g A跟足量新制Cu(OH)2反应,生成9g Cu2O,反应中A和耗用的Cu(OH)2的物质的量之比为1:2。
又已知5.5g B能跟2.5g NaOH完全反应,反应中B和NaOH是以等物质的量作用。试求:
B的结构简式及其名称。
37.(10分)A、B都是芳香族化合物,1 molA水解得1 molB和1 mol醋酸。A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量分数为65.2%,A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B分子量之差为 ;
(2)1个B分子中应该有 个氧原子;
(3)A的分子式是 ;
(4)B可能的三种结构简式是 、 、 。
下学期期中考试高二化学试题答案(理科)
一、选择题
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | C | A | B | A | D | C | D | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | BD | AD | C | A | B | C | AD | CD |
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | AD | BC | B | D | D | A | D | AC | BC | A |
二、31.(6分)CH3COOH CH3CH2CH2OH CH2CH(OH)CH3 (每空2分)
32.⑴10-8 ⑵6% ; 139.3
33.[(1) 为1分,其余每空各2分](1) C1:C1 (2) HCl、NH4CI (3) 0.6mol·L-1· S-1
(4) NH4++OH- △ NH3 ↑+H20
34. (E、F和反应类型各1分,其余每空各2分)
 (1)
(1)
|
|
|
| ||||||
|
| ||||||
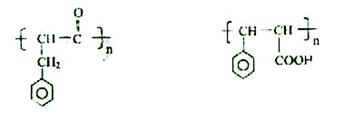
2)消去反应
![]() 35.(12分)
35.(12分)
![]() (1)CH2=CH—CH3 + Cl2 CH2=CHCH2Cl + HCl (取代反应)
(1)CH2=CH—CH3 + Cl2 CH2=CHCH2Cl + HCl (取代反应)
![]()
![]()
![]() (2)CH2=CH—CH2Cl + Cl2 CH2—CH—CH2
(加成反应)
(2)CH2=CH—CH2Cl + Cl2 CH2—CH—CH2
(加成反应)
Cl Cl Cl
![]() CH2OH
CH2OH
![]()
![]()
![]()
![]() (3)CH2CHCH2 + 3NaOH →
CHOH + 3NaCl (取代反应)
(3)CH2CHCH2 + 3NaOH →
CHOH + 3NaCl (取代反应)
Cl Cl Cl CH2OH
![]()
![]()
![]()
![]() (4)CH2OH
CH2ONO2
(4)CH2OH
CH2ONO2
![]()
![]() CHOH +
3HNO3 CHONO2 + 3NaCl (酯化反应)
CHOH +
3HNO3 CHONO2 + 3NaCl (酯化反应)
CH2OH CH2ONO2
(化学方程式各2分,反应类型各1分)
五、计算题
36.因为 nc : nH : nD = : : = 2 : 4 : 1 (2分)
所以 A、B最简式为 C2H4O2 最简式量 = 12×2 + 1×4 + 16×1 = 44
nCu2O = = 0.625 (mol)
A — 2Cu (OH) 2 — Cu2O
1 2 1
0.625mol 0.625mol
MA = = 44g/mol
n = = 1
所以A的分子式为C2H4O (2分)
A能跟足量Cu (OH) 2 反应生成 Cu2O,则A的结构简式为CH3CHO (2分)
B —— NaOH
1 1
mol mol
MB = 88 n = = 2
所以B的分子式为C4H8O2(2分),又因为B能与NaOH作用,所以B的结构简式为CH3OH2CH2COOH(1分)
![]() 或 CH3 (1分)
或 CH3 (1分)
CH3CHCOOH
37. (1)42 (2)3 (3)C9H8O4 (每空2分)
![]()
![]()
![]() (4)
OH
OH
CH
(4)
OH
OH
CH
![]()
![]()
![]()
![]()
![]() COOH
COOH
![]()
COOH
COOH