高二化学秋期中考试卷(文科)
(时间:90分钟 满分:100分 命题人:洪聪敏)
可能用到的原子量:H:1 N:14 O:16
第Ⅰ卷 选择题(共48分)
一、 选择题(每小题只有一个正确答案,每小题2分,共48分)
1、常温下密度最小的气体是 ( ) (A)Cl2 (B)SO2 (C)NH3 (D)N2
2、能用来干燥氨气的干燥剂是 ( )
(A)苛性钠溶液 (B)浓硫酸 (C)五氧化二磷 (D)碱石灰
3、收集下列气体时,不能用排空气法而只能用排水法的是( )
(A)O2 (B)H2 (C)NO (D)NO2
4、下列有关氨分子结构的叙述中正确的是 ( )
(A)正四面体形 (B)三角形
(C)三角锥形 (D)分子内键角为120°
5、下列物质的溶液,PH<7的是( )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
6、对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为![]() ,(x代表某反应物或生成物)之间的关系,正确的是(
)
,(x代表某反应物或生成物)之间的关系,正确的是(
)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
7.下列反应达到平衡后,减压或升温都能使化学平衡向逆反应方向移动的是( )
![]() A.S(s)O2 + SO2 (正反应为放热反应)
A.S(s)O2 + SO2 (正反应为放热反应)
![]() B.N2 +3H2
2NH3 (正反应为放热反应)
B.N2 +3H2
2NH3 (正反应为放热反应)
![]() C.C(s)+ CO2 2CO (正反应为吸热反应)
C.C(s)+ CO2 2CO (正反应为吸热反应)
![]() D. H2+I2(g) 2HI (正反应为吸热反应)
D. H2+I2(g) 2HI (正反应为吸热反应)
8、下列气态氢化物中,最不稳定的是( )
A、NH3 B、H2S C、PH3 D、H2O
9.下列各组金属在常温下都不能被浓硝酸溶解的是( )
(A)Mg Zn (B)Al Pt (C)Fe Ag (D)Cu Au
10.下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是( )
A、HCl、CaCO3、SO2 B、HClO、H2S、C2H5OH
C、KNO3、CH3COOH、NH3 D、BaSO4、H3PO4、H2O
11、下列属于纯净物的是( )
A.五水硫酸铜晶体 B.氨水
C.漂白粉 D.液氨
12、反应2SO2+O2 ![]() 2SO3是在恒温条件下的密闭容器中进行的,能够充分说明此反应已达到平衡的标志是(
)
2SO3是在恒温条件下的密闭容器中进行的,能够充分说明此反应已达到平衡的标志是(
)
A.容器中SO2、O2、SO3共存
B.容器中SO2、O2、SO3浓度相同
C.容器中SO2、O2、SO3的物质的量为2:1:2
D.容器中压强不随时间的变化而变化
13.向0.1mol/L氨水中逐渐加入一定量的水,始终保持增大的趋势的是:( )
A.NH3·H2O浓度 B. OH—浓度
C.NH4+数目 D. NH4+浓度
14、在2A + B = 3C + 4D的反应中,下列表示该反应速率最大的是( )
A、VA =0.5mol / (L.min) B、VB =0.3mol / (L.min)
C、VA =0.8mol / (L.min) D、VD = 1mol / (L.min)
15、pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
A.反应开始时的速率:甲=乙
B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲>乙
D.反应结速时,pH值:甲<乙
16、能直接由金属单质与酸反应得到的盐是( )
A.![]() B.
B.![]() C.
C. ![]() D.AgCl
D.AgCl
17、在Na2S溶液中,C(Na+)与C(S2-)的关系是( )
A、C(Na+)=C(S2-) B、C(Na+)∶C(S2-)=2∶1
C、C(Na+)∶C(S2-)>2∶1 D、C(Na+)∶C(S2-)<2∶1
18、下列离子方程式中错误的是( )
A、铝粉投入到NaOH溶液中:Al+2OH-=AlO2-+H2↑
B、Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O
C、Al(OH)3溶于H2SO4溶液中:Al(OH)3+3H+=Al3++3H2O
D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O
19、在NO2与水的反应中,NO2是( )
A、只是氧化剂 B、只是还原剂
C、既是氧化剂,又是还原剂 D、既不是氧化剂,又不是还原剂
20、一元强酸和一元强碱恰好完全中和时,它们起反应的( )一定相等
A、质量 B、质量分数
C、物质的量浓度 D、H+和OH-的物质的量
21、只用一种试剂,能将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是( )
A、NaOH溶液 B、AgNO3溶液
C、BaCl2溶液 D、Ba(OH)2溶液
22、pH相同的盐酸和醋酸两种溶液,它们的( )
A.H+的物质的量相同 B.H+的物质的量浓度相同
C.溶质的物质的量相同 D.溶质的物质的量浓度相同
23、下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①Ca(HCO3)2 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤(NH4)2S ⑥Al
A.②③ B.②③⑥ C.①②③⑤⑥ D.全部
24、下列氧化物与铝粉混合可作铝热剂的是 ( )
A.Fe2O3 B.MgO C.Na2O D.P2O5
高二化学
 秋期中考试卷(文科)
秋期中考试卷(文科)
(时间:90分钟 满分:100分 命题人:洪聪敏)
第Ⅰ卷 选择题(共48分)
一、选择题(每小题只有一个正确答案,每小题2分,共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
第Ⅱ卷 非选择题(共52分)
二、填空题(共31分)
25、(6分) 100ml 0.1mol/L的NaCl溶液呈______性;10ml 1mol/L 的Na2CO3溶液呈______性;1ml 5mol/L 的NH4Cl溶液呈_________性。(填酸性、碱性或中性)
26、(共8分,每空2分) ①在氯化铝溶液中加入少量的氢氧化钠溶液,可观察到现象: ____________________________ , ②在氢氧化钠溶液中加入少量的氯化铝溶液,可观察到现象: _____________________________ ,
写出①的化学方程式: _____________________ ,
写出②的离子方程式________________________________ 。
27、(6分)在一定条件下,下列反应达到平衡:
2HI(g) ==== H2(g) +I2(g)(正反应为吸热反应)
(1)如果升高温度,平衡混合物颜色_________________________。
(2)如果加入一定量H2,平衡___________________移动。
(3)如果使密闭容器体积增大,平衡_______________移动。
28、(5分)原电池是一种_____________________________的装置,一般说来,在原电池中,较活泼的金属发生___________________反应,是______极活动性较差的金属极上发生_______________反应,是_____极。
29、(6分)写出下列反应的化学方程式。
(1)![]() 和盐酸的反应_____________________________________________
和盐酸的反应_____________________________________________
(2)![]() 和
和![]() 的反应__________________________________________
的反应__________________________________________
三、实验题(本题共1小题,每空2分,共10分)
30、(每空2分,共10分)氨气的密度比空气小,极易溶于水。实验室制取氨气有几种方法。下图A、B是实验室制气体的两种发生装置,C、D是两种收集装置,E、F是两种吸收装置。
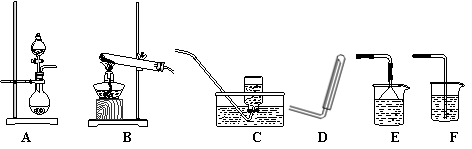 |
(1)当用NH4Cl固体和Ca(OH)2固体来制取氨气时的气体发生装置与制氧气发生装置相同,应选用的发生装置是(填编号) ,该反应的化学方程式是 ;
(2) 收集氨气时应选用的收集装置是(填编号) ;
(3)欲得到干燥的氨气,应选择的干燥剂是 ;
A、浓硫酸 B、碱石灰 C、P2O5
(4)欲用蒸馏水吸收氨气制氨水,应选择的吸收装置是所给装置中的(填编号) 。
四、计算题(本题包括2小题,共11分)
31、(5分)在标准状况下,336体积的氨气溶于1体积水中,求制得的氨水的溶质的质量百分数和物质的量浓度。(氨水密度为0.92g/cm3)
解:
![]() 32、(6分) 将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡: 2SO2 + O2 2SO3 测得平衡时混合物总的物质的量为5mol,求:
32、(6分) 将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡: 2SO2 + O2 2SO3 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
解:
秋期中考高二化学试卷(文科)参考答案
(时间:90分钟 满分:100分)
第Ⅰ卷 选择题(共48分)
一、选择题(每小题只有一个正确答案,每小题2分,共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| C | D | C | C | C | A | B | C | B | C | A | D |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| C | C | A | A | C | A | C | D | D | B | C | A |
第Ⅱ卷 非选择题(共52分)
二、 填空题(共31分)
25、(6分)中性、碱性、酸性
26、(共8分,每空2分)白色沉淀, 先有白色沉淀生成后溶解; AlCl3+3NaOH=Al(OH)3↓ +3NaCl Al3+ + 4OH-=AlO2-+2H2O
27、(6分)(1)加深 (2)逆反应方向 (3)不
28、(5分)将化学能转化成电能 还原 负 氧化 正
29、(6分)(1)![]() (2)
(2)![]()
三、实验题(本题共1小题,每空2分,共10分)
30、(每空2分,共10分)
(1)B
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O↑
CaCl2+2NH3↑+2H2O↑
(2)D
(3)B
(4)E
四、计算题(本题包括2小题,共11分)
31、(5分)20.3% 11 mol/L
32、(6分)解:设有已转化的SO2为X mol
![]() 2SO2 + O2 2SO3
2SO2 + O2 2SO3
起始(mol) 4 2 0
转化(mol) X 0.5X X
平衡(mol) 4-X 2-0.5X X
(4-X)+(2-0.5X)+ X=5 X=2(mol)
平衡时各物质的浓度为:C(SO2)=(4-2) mol/4L=0.5 mol/L
C(O2)=(2-1) mol/4L=0.25 mol/L
C(SO3)= 2 mol/4L=0.5 mol/L
平衡时SO2的转化率为: (2/4) ×100% = 50%
答:略