高二化学基础测试
一、选择题(本大题共30分,每小题有1~2个选项符合题意)
1.在标准状况下,将3.36 L NH3通入100 mL 1 mol/L的H3PO4溶液中,充分反应后,生成的盐是( )
A.(NH4)2HPO4和(NH4)3PO4 B.(NH4)3PO4
C.NH4H2PO4 D.NH4H2PO4和(NH4)2HPO4
2.下列化合物只含共价键的是( )
A.HNO3 B.NH4Cl C.Na2O2 D.H3PO4
3.下列大气污染物中,能与人体血红蛋白结合而引起中毒的气体是( )
A.SO2 B.Cl2 C.NO D.CO
4.充满NO和NO2的混合气体45 mL的试管,倒立于水中,一段时间后,气体的体积为35 mL,则原混合气体中,NO和NO2的体积比为( )
A.2∶7 B.7∶2 C.2∶1 D.9∶7
5.下列各组气体在常温下能共存的是( )
A.H2S和SO2 B.N2和O2 C.NO和O2 D.H2和F2
6.下列反应中,不能生成磷酸的是( )
A.P2O5加到热水中 B.红磷与浓HNO3共热
C.P2O5加到冷水中 D.Ca3(PO4)2与浓H2SO4反应
7.浓硝酸跟下列物质反应时,硝酸既表现出酸性,又表现出氧化性的是( )
A.Cu B.FeO C.CuO D.H2S
8.关于红磷和白磷的下列说法中,正确的是( )
A.都易溶于CS2 B.在氧气中燃烧的产物相同
C.可以相互转化 D.白磷是分子晶体,红磷是原子晶体
9.工业上用稀硝酸制取浓硝酸时,加入吸水剂后,再蒸馏浓缩,常用的吸水剂是( )
A.无水CaCl2 B.Mg(NO3)2 C.碱石灰 D.浓H2SO4
10.下列叙述(反应)中,不属于氮的固定的是( )
A.在放电条件下N2和O2化合成NO B.根瘤菌把氮气变为硝酸盐
C.把氨气制成硫酸铵 D.N2和H2合成NH3
11.在实验室能用同一气体发生装置制取的气体是( )
A.NH3和O2 B.H2和CO2 C.NO2和HCl D.O2和Cl2
12.在NO2被水吸收的反应中,发生还原反应与发生氧化反应的物质,其质量比为( )
A.2∶1 B.1∶2 C.1∶3 D.3∶1
13.在常温下都不能被浓硝酸腐蚀的一组金属是( )
A.Pt、Zn、Hg B.Cu、Ag、Sn C.Fe、Pb、Ba D.Al、Fe、Au
14.下列离子中能在硝酸溶液中大量共存的是( )
A.S2- B.Fe2+ C.SO42- D.SO32-
15.各取0.1 mol Cu分别投入足量的下列4种酸溶液中(必要时可以加热):①浓硫酸②浓硝酸 ③稀硝酸 ④稀硫酸,充分反应后得到的气体体积(相同条件下)由大到小的顺序是( )
A.②①③④ B.②①④③ C.②④①③ D.③④①②
二、填空题(本大题共55分)
16.氮族元素包括(用元素符号表示)_________五种元素。它们位于元素周期表中第___族。以R来表示氮族元素,它们的气态氢化物的化学式为________;最高价氧化物的化学式为_________,该氧化物水化物的化学式为_______。
17.浓硝酸在常温下见光或受热发生分解,其反应方程式__________,所以浓硝酸必须盛放在_________储存在__________;浓硝酸与浓盐酸按物质的量比为__________的混合物叫__________,不受硝酸侵蚀的_______和______两种金属都能被溶解。
18.实验室里若用如右图所示装置制取氨气,试用表格形式列出图中装置的错误之处,并用文字简要说明如何改正。

| 错误之处 | 应如何改正 |
| 1. | |
| 2. | |
| 3. | |
| 4. | |
| 5. |
19.从某些方面看,氨与水相当;NH4+与H3O+(H+)相当;NH2-与OH-相当;NH2-(有时包括N3-)与O2-相当。已知下列反应都能发生,请完成并配平这些化学方程式
(1)NH4Cl+KNH2→____________________________
(2)NH4I+PbNH→_____________________________
(3)K+NH3→_________________________________
CaO+NH4Cl→__________________________________
20.汽车尾气(含CO、NO、SO2等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个催化转换器(用铂、铝合金作催化剂),它的特点是使CO与NO反应,生成可参与大气生态循环的无毒气体,并促使汽油的完全燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式_________________。
(2)控制城市污染源的方法有__________________。
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
21.配平下列化学方程式,将系数填在空格内。
(1)______BiO3-+_____Mn2+_____H+=Bi3+____MnO4-+H2O
(2)______Cu2S+_____HNO3=____Cu(NO3)2+____NO↑+____H2SO4+H2O
22.下图所示为A、B、C、D、E五种物质的相互转化关系:
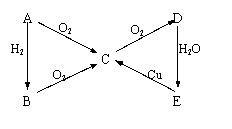 |
(1)若A通常状况下为固态单质,则A→E分别为(写出化学式):
A______B_____C______D______E______
(2)若A通常状况下为气态单质,则A→E分别为:
A______B_____C______D______E______
(3)写出(2)中物质转化的化学方程式:
A→B__________________;C→D___________________;
A→C__________________;D→E___________________;
B→C__________________;E→C___________________。
23.(本题共7分)
有白色晶体X,它跟NaOH溶液共热时,产生一种能使润湿的红色石蕊试纸变蓝的无色气体Y;晶体X跟浓硫酸混合时,产生一种能使润湿的蓝色石蕊试纸变红的气体Z;在气体Z的水溶液中滴入AgNO3溶液会产生一种白色沉淀,气体Y和Z相遇时产生白烟。
试根据以上事实写出:
(1)X、Y、Z 3种物质的化学式:
___________ 、 __________ 、 _________
(2)化学方程式:
X+NaOH __________________________。
X+H2SO4(浓)____________________。
五、计算题(本题共15分)
24.为了测定某铜银合金的成分,将30.0 g合金完全溶于80 mL 13.5 mol/L的浓HNO3中,待合金完全溶解后,收集到6.72 L(标准状况)气体,并测得溶液的[H+]=1 mol/L。假设反应后溶液的体积仍为80 mL。试计算:(1)被还原的硝酸的物质的量;(2)合金中银的质量分数。
25.由NO2和O2组成的混合气体10 mL,装入试管中,再倒置于盛有水的水槽里,一段时间后,试管内剩余气体为1 mL。求原混合气体中NO2和O2各多少(气体体积均为同温同压下测定)。
参考答案
一、 选择题
1.D 提示:H3PO4是三元酸,NH3·H2O是一元碱,二者按物质的量之比1:1反应时,产物是磷酸二氢盐,按1:2反应时,产物是磷酸一氢盐,1:3反应,得磷酸盐,据题意,二者物质的量之比为1:1.5,间于1:1和1:2之间,所以,产物是磷酸二氢盐和磷酸一氢盐的混合物。
2.A、D
3.C、D
4.C 提示:NO和NO2的混合气体遇水时,其中的NO2与水反应:3NO2+H2O=2HNO3+NO,即3体积NO2参加反应,混合气体体积就减小2体积,据题意,混合气体的体积减小了10 mL,所以反应了的NO2的体积为15 mL,则NO的体积为30 mL。
5.B
6.C
7.A、B
8.B、C
9.B、D
10.C
11.A、B
12.B
13.D
14.C
15.A
二、 填空题
 16.N、P、As、Sb、Bi ;VA;RH3 R2O5,HRO3、H3RO4。
16.N、P、As、Sb、Bi ;VA;RH3 R2O5,HRO3、H3RO4。
17. 棕色玻璃瓶 冷暗处;1:3; 王水 ; Pt Au
18.
| 错误之处 | 应如何改正 |
| 1.试管a安装有误 | 试管a的管口应向下倾斜 |
| 2.夹试管a的铁夹的位置 | 铁夹应夹在距试管口1/3处 |
| 3.试管b安装有误 | 试管b口应向下 |
| 4.试管b不带塞子 | 把试管b口处的塞子换成一小团棉花 |
| 5.没有对反应物进行加热 | 用酒精灯对a试管内的药品进行加热 |
19.
(1)NH4Cl+KNH2=KCl+2NH3
(2)2NH4I+PbNH=PbI2+3NH3
(3)K+NH3=KNH2+H2↑
(4)CaO+2NH4Cl=CaCl2+H2O+2NH3
20.
(1)2NO+2CO=N2+2CO2
(2)AB
21.
(1)5,2,14,5,2,7
(2)3,22,6,10,3,8
22.
(1)S,H2S,SO2,SO3,H2SO4
(2)N2,NH3,NO,NO2,HNO3
(3)略
提示:在常见的物质中,能被连续氧化的无机物有:N2、S、H2S、NH3。根据题意,五种物质中A、B一次氧化得C,C继续被氧化得D,所以A、B为可被连续氧化的物质,必在上述四种物质范围之内。
23.
(1)NH4Cl 、NH3 、HCl 。
提示:中学化学中能使润湿的红色石蕊试纸变蓝的无色气体只有NH3。
(2)NH4Cl+NaOH=NH3↑+NaCl+H2O
NH4Cl(s)+H2SO4(浓)=NH4HSO4+HCl↑
三、计算题
24.
(1)0.3 mol (2)36 %
提示:(1)依据氮原子守恒,被还原的硝酸的物质的量与被还原后所得气体物质的量相同:6.72/22.4=0.3 mol
(2)硝酸的总物质的量为:0.08 L×13.5 mol/L=1.08 mol
剩余硝酸的物质的量为:0.08 L×1 mol/L=0.08 mol
参加反应的硝酸的物质的量为:1.08 mol-0.08 mol=1 mol
所以,反应中做酸的硝酸的物质的量为:1 mol-0.3 mol=0.7 mol
设铜的物质的量为x,银的物质的量为y,则:64x+108y=30 g
铜是二价金属,1 mol铜要与2 mol硝酸成盐,同理,1 mol Ag要1 mol硝酸成盐,
则:2x+y=0.7
∴ y=0.1 mol
![]()
25.
两组解:7.2 mL NO2和2.8 mL O2 (过量为O2)
8.6 mL NO2和1.4 mL O2 (过量为NO2,剩余气体为NO)