高二化学检测试卷
一、单项选择题(3×18=54分)
1.已知 X为ⅡA族元素,Y为ⅦA族元素,则由X与Y组成的化合物的化学式是 [ ]
A.XY2 B.X2Y C.X2Y3 D.X2Y5
2.下列叙述中,正确的是 [ ]
A.H2SO4的摩尔质量是98 B.等质量的O2和O3中所含的氧原子个数相等
C.等质量的CO2和CO中所含的碳原子个数相等
D.将98gH2SO4溶解于500 mL水中,所得溶液中H2SO4的物质的量浓度为2 mol/L
3.在下列物质中,含有分子数目最多的是 [ ]
A.22.4 LH2 B.3.01×1023个Cl2
C.9×10-3kg H2O D.600mL2mol/L蔗糖溶液中的溶质
4.在下列反应中,既能放出气体,又是氧化还原反应的,且气体只是氧化产物的是 [ ]
A.浓盐酸与二氧化锰共热 B.石灰石与稀盐酸反应
C.过氧化钠与水反应 D.铁与稀硫酸反应
5.在下列物质水溶液中分别加入澄清的石灰水后,原溶液中的阴离子和阳离子都减少的是
A. CuSO4 B .Ba(NO3)2 C.Na2CO3 D.FeCl2
6.在化学上,常用CaH2作为制取氢气的药剂,有关的化学反应方程式为:
CaH2+2H2O=Ca(OH)2+2H2↑在这个反应中,H2O的作用 [ ]
A.是还原剂 B.是氧化剂 C.是溶剂 D.既不是氧化剂,也不是还原剂
7.X、Y、Z是周期表中三种相邻的元素,X和Y同周期,Y和Z同主族。这三种元素原子的最外电子层中电子数的总和是17,核内质子数的总和是31,则X、Y、Z三种元素是下列各组中的 [ ]
A.N、O、S B.O、S、P C.O、F、Cl D.C、Si、P
8.下列分子中,具有极性键的非极性分子是 [ ]。
A.H2O B.NH3 C.CCl4 D.Br2
9.下列化合物中既含有离子键又含有极性共价键的是 [ ]。
A.NaBr B.NH4Cl C.KI D.CaCl2
10.将0.l mol N2O4置于1L密闭烧瓶中,然后将烧瓶放入100℃的恒温槽里,烧瓶内的气体逐渐变为红棕色:N2O4(g)(无色)![]() 2NO2(g)(红棕色)
2NO2(g)(红棕色)
下列结论不能说明上述反应在该条件下已经达到平衡状态的是 [ ]。
A.烧瓶内气体的颜色不变,不再加深
B.N2O4的消耗速率与NO2的生成速率之比为1:2
C.NO2的生成速率与NO2的消耗速率相等 D.NO2的物质的量浓度不变
11.某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡,此时测得n(A):n(B):n(C)=2:2:1。若保持温度不变,以n(A):n(B):n(C)= 2:2:1的比例向该容器中再充入A、B和C则 [ ]。
2C(g)达到平衡,此时测得n(A):n(B):n(C)=2:2:1。若保持温度不变,以n(A):n(B):n(C)= 2:2:1的比例向该容器中再充入A、B和C则 [ ]。
A.平衡向正反应方向移动 B.平衡向逆反应方向移动
C.平衡不发生移动 D.A的百分含量增大
12.下列事实能说明醋酸属干弱电解质的县 [ ]。
①中和 10 mL 1 mol/L CH3COOH溶液需要 10 mL1 mol/L NaOH溶液
②物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快
③0.01 mol/L醋酸溶液的pH大于2
④0.1 mol/L CH3COONa溶液显碱性
A.①②③ B.②③④ C.①③④ D.①④
13.向含有①Mg2+,②Fe2+,③NH4+,④Al3+的溶液中,加入过量的NaOH溶液,加热并搅拌,再加入过量盐酸,溶液中减少的阳离子是 。
A.①② B.①④ C.③④ D.②③
14.将等物质的量的Mg和Al混合均匀,分成四等份,分别加到下列四种过量的溶液中,充分反应后,放出H2最多的是 [ ]。
A.3 mol/L HCl溶液 B.4 mol/L HNO3溶液
C.8 mol/L NaOH溶液 D.18 mol/L H2SO4溶液
15.下列离子方程式正确的是 [ ]。
![]()
B.氯化铁溶液中加入铁粉:Fe+Fe3+=2Fe2+
C.硫酸铜溶液中加入硫化氢溶液:Cu2++S2-=CuS↓
D.碳酸氢镁溶液中加入足量烧碱溶液:
![]()
16.下列各组离子,在强碱性溶液中可以大量共存的是 [ ]。
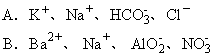
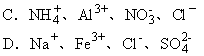
17.某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可能 [ ]。
A.C3H8 B.C4H10 C.C5H12 D.C6H14
18.下列说法中正确的是 [ ]。
A.淀粉和纤维素是能水解成多个分子单糖的糖类 B.淀粉和纤维素都是纯净物
C.人造丝和蚕丝都是蛋白质 D.分子式符合Cn(H2O)m的,一定是糖类化合物
二、实验题
19.(8分)分要除去下列物质中所混有的少量杂质,应加入什么试剂?写出有关反应的化学方程式。
(1)铁粉中混有少量铝粉。
(2)FeC12溶液中混有少量FeCl3。
(3)Na2CO3中含有少量NaHCO3。
(4)乙烷中混有少量乙烯。
20(8分)可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:

(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_______
________________________________________________________________
(3)实验中加热试管的目的是:
① _____________________________________________________________
② _____________________________________________________________
(4) 试管b中加有饱和Na2CO3溶液 ,其作用是__________________________
_____________________________________________________________
(5)反应结束后,振荡试管b静置,观察到的现象是___________________________________________________________________
三、综合题
21(10分)莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
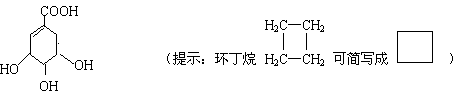
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是
____________________________________________________________
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是
_________________________________________________________________
(4)17.4克A与足量碳酸氢钠溶液反应,计算生成二氧化碳的体积(标准状况)。
(5)A在浓硫酸作用下加热可得到B(B的结构简式为![]() ),其反应类型________________________-。
),其反应类型________________________-。
(6)B的同分异构体中既含有酚羟基又含有酯基的共有__________种,写出其中一种同分异构体的结构简式_________________________________________。
22(全国Ⅱ)(9分)
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以气态化合物,则
(1)X是 、Y是 、Z是
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是
和
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是
23.(11分)中学化学中几种常见物质的转化关系如下:
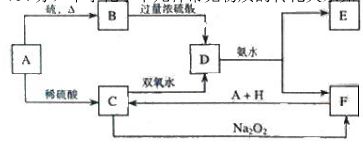
将 D溶液滴入沸水中可得到以 F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中 F粒子直径大小的范围:___________________。
(2)A、B、H的化学式:A __________、B ___________、H ___________。
(3)①H2O2 分子的电子式:________________ 。
②写出 C的酸性溶液与双氧水反应的离子方程式:____________________________。
(4)写出鉴定 E中阳离子的实验方法和现象:
(5)在 C溶液中加入与 C等物质的量的 Na2O2,恰好使 C转化为 F,写出该反应的离子方程式:
高二化学检测试卷答案
一、单项选择题(3×18=54分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | B | D | A | A | B | B | B | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| A | A | B | D | A | D | B | C | A |
二、实验题
19.(8分)(1)NaOH溶液,2NaOH+2Al+2H2O= 2NaAlO2+3H2↑
(2)足量铁粉、Fe+2FeCl3=3FeCl2。
(3)加热、2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(4)溴水 、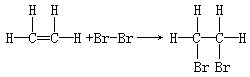 。
。
20 (1)先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸
(如在试管a中最先加入浓硫酸,此题得0分)
(2)在试管a中加入几粒沸石(或碎瓷片)
(3) ①加快反应速率
②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动
(4)吸收随乙酸乙酯蒸出的少量酸性物质和乙醇 (5)b中的液体分层,上层是透明的油状液体
三、综合题
21(1)C7H10O5
(2)
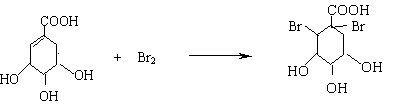
(3)

(4)
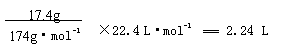
(5) 消去反应
(6) 3
 或
或 或
或 
22⑴氢 氮 氧
⑵N2O5
⑶ NH4+ HO-
⑷NH4NO3
28、(15分)
⑴ Fe2O3 CO
⑵ ① Fe2O3 + 3 CO ![]() 2 Fe + 3 CO2
2 Fe + 3 CO2
② CO + H2O ![]() CO2 + H2
CO2 + H2
③ C + H2O ![]() CO + H2 (如写可逆号,同样正确)
CO + H2 (如写可逆号,同样正确)
23.(1)1nm—100nm
(2)Fe FeS H2SO4(稀)
(3)① ![]()
② 2Fe2+ +H2O2 +2H+ ==2Fe3+ +2H2O
(4)取少量 E于试管中,用胶头滴管入 NaOH溶液,加热试管,可观察到试管口处湿
润的红色石蕊试纸变蓝。(或其他合理答案)
(5)4Fe2+ +4Na2O2+6H2O ==4Fe (OH)3↓+O2↑+8Na +