高二化学第一学期期中考试样卷试题卷(理科)3
相对原子质量:H:1 O:16 , N:14 S:32,Cu:64,Ba:137
一、选择题(只有一个正确选项,3‘×18=54‘)
1、下列气体中,既可用排空气法收集,又可用排水法收集的是
A、NO B、H2 C、NH3 D、NO2
2、在NO2与水的反应中,NO2
A、只是氧化剂 B、只是还原剂
C、既是氧化剂,又是还原剂 D、既不是氧化剂,又不是还原剂
3、试管中盛有少量白色固体,可能是铵盐,检验的方法是
A、 加水,将湿润的红色石蕊试纸放在试管上
B、 加NaOH 溶液,加热,将湿润的红色石蕊试纸放在试管上
C、 加NaOH溶液,加热,滴入酚酞试剂
D、加NaOH溶液,加热,滴入紫色石蕊试剂
4、在反应N2+3H2![]() 2NH3中,经过一段时间后,NH3的浓度增加0.6mol/1在此段时间内用H2表示平均反应速率为0.45mol/1·S,则反应所经历的时间为
2NH3中,经过一段时间后,NH3的浓度增加0.6mol/1在此段时间内用H2表示平均反应速率为0.45mol/1·S,则反应所经历的时间为
A、1S B、0.44S C、1.33S D、2S
5、在密闭容器中进行下述反应,a A (g)+b B (g) ![]() c(C)(g)+
dD (g),当反应达平衡时C的浓度为(C1),然后向容器中加入一定量的C,待反应再一次达平衡时,C的浓度为(C2),则(C1)和(C2)的关系是
c(C)(g)+
dD (g),当反应达平衡时C的浓度为(C1),然后向容器中加入一定量的C,待反应再一次达平衡时,C的浓度为(C2),则(C1)和(C2)的关系是
A、(C1)<(C2) B、(C1)>(C2)
C、(C1)=(C2) D、不一定,要视反应中的化学计量数而定
6、将CO和H2O(g)按物质的量为1:2进行混合,在一定条件下反应CO+H2O(g) ![]() CO2+H2达平衡时,CO的转化率为25%,则平衡混合气的平均相对分子质量
CO2+H2达平衡时,CO的转化率为25%,则平衡混合气的平均相对分子质量
A、24 B、21.33 C、19.50 D、23
7、下列溶液肯定呈酸性的是
A、含有H+的溶液 B、酚酞显无色的溶液
C、C(OH-)<C(H+)的溶液 D、PH值小于7的溶液
8、在CH3COOH![]() H++CH3OO-的电离平衡中,要使电离平衡右移且C(H+)增大,应采取的措施是
H++CH3OO-的电离平衡中,要使电离平衡右移且C(H+)增大,应采取的措施是
A、加入NaOH B、加入盐酸 C、加入 D、加热
9、下列有关0.1mol/L Na2CO3溶液的说法中错误的是
A、C(Na+)=0.2mol/L B、C(OH-)>C(H+),C(HCO3-)>C(CO32-)
C、C(Na+)≠2C(CO32-) D、C(H2CO3) ≠0
10、25C°PH和体积均相等的氨水和烧碱溶液中,C(NH4+)与C(Na+)的关系的正确的是
A、C(NH4+)>C(Na+) B、C(NH4+)=C(Na+)
C、C(NH4+)<C(Na+) D、无法确定
11、25ml的滴管中装有标准盐酸,用来滴定未知浓度的NaOH溶液时,下列情况中对测定结果无影响的是
A、 酸式滴定管用蒸馏水清洗后,即装入标液
B、 滴定前,锥形瓶用待测液清洗2—3次
C、 在盛有20ml待测的瓶中加适量的蒸馏水
D、达终点时,耗去盐酸的体积为25.50ml
12、下列各组物质的颜色变化,可用勒夏特列原理解释的是
① 氯水在光照下,颜色变浅 ②H2、I2、HI平衡混和气加压后颜色变深
② FeCl3溶液加铁粉后颜色变浅 ④FeCl3溶液加热后颜色变深
A、①② B、②③ C、③④ D、①④
13、二氧化氮存在下列平衡,2NO2(g) ![]() N2O4(g)+Q,在测定NO2的相对分子质量时,下列条件中较为适宜的是
N2O4(g)+Q,在测定NO2的相对分子质量时,下列条件中较为适宜的是
A、130℃,3.03×105Pa B、25℃,1.01×105Pa
C、130℃,5.05×104Pa D、0℃,5.05×104Pa
14、物质的水溶液能导电,且该物质属于非电解质,溶于水时化学键被坏的是
A、硝酸 B、硫酸铵 C、二氧化硫 D、液氯
15、将0.2mol/1的醋酸钠溶液20ml与0.1mol /1盐酸20ml混合物,溶液显酸性,则溶液中有关微粒的溶液关系正确的是
A、C(AC-)>C(Cl-)>C(H+)>C(OH-) B、C(Cl-)>(C(AC-)>C(HAc)>C(H+)
C、C(Ac-)=C(Cl-)>C(H+)>C(HAc) D、C(Na+)+C(H+)=C(Ac-)+C(OH-)
16、某无色透明的下列溶液,在PH=0的条件下,能大量共存的是
A、Mg2+、NH4+、Br-、SO42- B、Cu2+、K+、NO3- 、Cl-
C、Ba2+、NH4+、CO32-、NO3- D、Na+、H+、CH3COO-、SO42-
 17、可逆反应X2(g)+3Y2(g)
17、可逆反应X2(g)+3Y2(g)![]() 2XY3(g)+Q(Q>0)达平衡后,下图的曲线符合勒夏特列原理的是
2XY3(g)+Q(Q>0)达平衡后,下图的曲线符合勒夏特列原理的是
18、有人曾建议用AG表示溶液的酸度,AG的定义为AG=lg![]() ,下列表述正确的是
,下列表述正确的是
A、 在25℃时,若溶液呈中性,则PH=7,AG=1
B、 在25℃时,若溶液呈酸性,则PH=7,AG<0
C、 在25℃时,若溶液呈碱性,则PH=7, AG>0
D、25℃,溶液呈碱性,则PH>7,AG>0
二、填空题(20分)
19、在浓硝酸中放入铜片
(1) 开始反应时的化学方程式为__________实验现象为________________
(2) 若铜有剩余,则反应将要结束时的反应方程式是__________________
(3) 待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是___________
(4) 若将12.8g铜跟一定量的浓HNO3反应,铜耗完时,共产生气体5.61(标况),则所消耗的硝酸的物质的量是_____________,所得气体的平均相对分子质量为__________。
20、在一密闭容器中,某可逆反应mX+nY![]() PZ, 在一定条件下达到平衡,已知m+n=p,X是固体,Z是气体。如果对体系加压,则化学平衡向____________方向移动,如升高温度时Y的转化率降低,则反应是_____________热反应。
PZ, 在一定条件下达到平衡,已知m+n=p,X是固体,Z是气体。如果对体系加压,则化学平衡向____________方向移动,如升高温度时Y的转化率降低,则反应是_____________热反应。
21、温室下,0.1mol/1的下列四种溶液,a:NH4Cl,b:Ba(OH)2 ,C:HCl,
d :Na2SO4中,溶液的PH从大到小的顺序是___________,水的电离程度从大到小的顺序是________________。
三、实验题
22、若用0.1mol/LNaOH 溶液滴定未知浓度的某一元强酸,判断下列情况下所造成的误差,使测得的浓度是偏高还是偏低或者无影响。
a) 碱式滴定管用蒸馏水洗净后,未用标准液润洗。____________-
b) 一定体积的酸溶液注入锥形瓶后,加入蒸馏水稀释。____________
c) 滴定操作时,摇动锥形瓶,待测液溅出。_______________
d) 酸滴定管用蒸馏水洗净后,未用待测液润洗。_____________
e) 标准液加入滴定管,开始滴定时发现液面在0刻度,而尖嘴部分留有气泡,滴定完毕后气泡消失。___________
23、(1)实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为:
NaNO2+NH4Cl====NaCl+N2+2H2O+Q,实验装置如图(1)所示,试回答:
① 置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)
1. 防止NaNO2饱和溶液蒸发
2. 保证实验装置不漏气
3. 使NaNO2饱和溶液容易滴下
② 部分的作用是______________
a、冷凝 b、冷却氮气 c缓冲氮气流
③加热前必须进行的一个操作步骤是________;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是____________
④集N2前,必须进行的步骤是(用文字说明)__________。收集N2最适宜的方法(填写编号)_____________。
1.
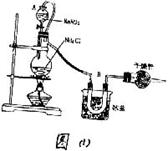 用排气法收集在集气瓶中
用排气法收集在集气瓶中
2. 用排水法收集在集气瓶中
3. 直接收集在球胆中
(2)实验室合成氨装置如图(2)所示,试回答:
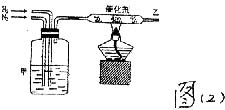
装置甲的作用是既能干燥气体,又能观察N2、H2、混合的流速,则甲中所装的物质是______________。
从乙处导出的气体是____________;检验产物的简单化学方法是________________。
四、计算题(12分)
24、(4分)350体积(标况)的氨溶解在1体积水(р=1g/cm3)里,求所得氨水(р=0.294g/cm3)中NH3的质量分数和物质的量浓度?
25、(8分)500molPH=1的稀硫酸和HCl的混合液与50mlBa(OH)2,充分反应后过滤,得沉淀0.466g,溶液的PH值变为13,
求①原混合液中的SO42-、Cl-的物质的量浓度
②Ba(OH)2溶液的物质的是浓度
第一学期期中考试样卷
高二化学答题卷(理科)
一、选择题(3×18=54分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| B | C | B | D | A | B | C | D | B | B | C | D | C | C | A | A | A | D |
二、填空题(20分)
19、(1)Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O 现象 铜片溶解,有红棕色气体产生溶液变绿色
(2)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)原因溶液中H+和NO3-和Cu 反应
(4)____________0.65_mol_____________,平均相对分子质量___41.2
20、平衡向逆(左) 方向移动,反应是放热热反应
21、PH从大到小的顺序是b d a c
水的电离度从大到小的顺序是a d c b
三、实验题(14分)
22、a 偏向 b 无影响 c 偏低 d偏低 e偏高
23、①C ② a ③ 检验气密性 原因 该反应是放热反应
④将装置中的空气赶净, 方法 C
(2)甲中所装的物质是 浓H2SO4
乙处导出的气体是NH3 N2 H2
检验方法(1)湿润的红色石蕊试纸 (2)用蘸有浓盐酸的玻棒
5、计算题(12分)
24、氨水的质量分数=20.99%
C(氨水)=11.4mol/L
25、(8分)n(SO42-)=0.002mol n(Cl-)=0.046mol
(1)原溶液中 C(SO42-)=4×10-3mol/L
C(cl-)=9.2×10-2mol/L
(2)C(BaCOH)2=1.05mol/L
