|
| |
一、选择题(只有一个正确答案,共20小题,每小题3分,共60分)
| |
A.7.35—7.45 B.8.11—9.20 C.5.55—6.55 D.10.02—11.34
2.酸和碱恰好完全中和时,它们起反应的下列哪个量一定相等( )D
A.质量 B.物质的量 C.物质的量浓度 D.H+和OH-的物质的量
3.将pH试纸用蒸馏水湿润后,去测定某溶液的pH值,该溶液的pH值将会D
A.偏高 B.偏低 C.不变 D.上述三种情况均有可能
4.根据酸碱质子理论:凡是能给出质子(即氢离子)的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。按照此理论,下列粒子属于两性物质的是( )C
A.NO2- B.H3O+ C.H2PO4- D.NH4+
5.氨水中的分子有( )
(A)1种 (B)2种 (C)3种 (D)4种
6.对于可逆反应,当确知其平衡向正反应方向移动时,下列说法中正确的是( )
A.反应物的转化率一定增大 B.生成物的质量分数一定增大
C.生成物的浓度一定增大 D.生成物的产量一定增大
7.酸式盐的水溶液是( )D
A 一定呈酸性 B 一定呈碱性 C 一定呈中性 D 不能肯定呈酸性还是呈碱性
8.在蒸发皿中加热蒸干并灼烧下列物质的溶液可以得到该物质的固体是( )A
A.Na2SO4 B.NH4HCO3 C.FeCl3 D.Ca(HCO3)2
9.25℃时,在浓度为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)Fe(SO4)2的溶液中,测得C(NH4+)分别为a、b、c(单位为mol/L)。下列判断正确的是
A、a = b = c B、a > b > c C、a > c > b D、c > a >b
10. 下列溶液中,pH最大的是( )
A.![]() 溶液 B.0.03 mol/L
NaOH溶液
溶液 B.0.03 mol/L
NaOH溶液
C.![]() 溶液 D.0.05 mol/L
NaCl溶液
溶液 D.0.05 mol/L
NaCl溶液
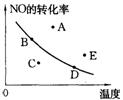 11.右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)
11.右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)![]() 2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且正反应速率大于逆反应速率的点是( )A
2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且正反应速率大于逆反应速率的点是( )A
A.C B.A或E C.B D.D
![]() 12.将0.1molN2O4置于1L密闭烧瓶中,然后将烧瓶放入100℃的恒温槽,烧瓶内的气体逐渐变为红棕色:N2O4(g)(无色) 2NO2(g)(红棕色)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )B
12.将0.1molN2O4置于1L密闭烧瓶中,然后将烧瓶放入100℃的恒温槽,烧瓶内的气体逐渐变为红棕色:N2O4(g)(无色) 2NO2(g)(红棕色)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )B
A. 烧瓶内气体的颜色不变,不再加深
B. N2O4的消耗速率与NO2的生成速率之比为1:2
C. NO2的消耗速率与NO2的生成速率相等
D. NO2的物质的量浓度不变
13.对已达化学平衡的下列反应:2X(g)+Y(g)![]() 2Z(g)减小压强时,对反应产生的影响是( )C
2Z(g)减小压强时,对反应产生的影响是( )C
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
14.在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3 ![]() N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是( )
A.3mol H2和1mol N2 B.2mol NH3和1mol N2
B.2mol N2和3mol H2 D.0.1mol NH3、0.9mol N2、2.85mol H2
15.在一定温度下,在一个密闭容器中加入H2和I2蒸气各0.5mol,发生反应
H2+I2![]() 2HI,达到平衡时,生成HI 0.8mol。若其它条件不变,开始充入的H2改为2mol,则达到平衡时生成的HI可能是下列中的( )B
2HI,达到平衡时,生成HI 0.8mol。若其它条件不变,开始充入的H2改为2mol,则达到平衡时生成的HI可能是下列中的( )B
A.1.1mol B.0.87mol C.0.8mol D.0.5mol
 16.今有反应2X(气)+Y(气)
16.今有反应2X(气)+Y(气)![]() 2Z(气)(正反应放热)右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是( )D
2Z(气)(正反应放热)右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是( )D
A.升高温度或降低Y的浓度
B.加入催化剂或增大X的浓度
C.缩小体积或降低X的浓度
D.降低温度或增大Y的浓度
17.在相同的温度下,浓度同为0.5mol/L的Na2CO3溶液比NaHCO3溶液的pH: ( )
A. 大 B. 小 C. 相等 D. 不能确定
18.下列说法正确的是( )A
A.室温下,pH=8的碱性溶液中,可能存在CH3COOH分子
B.室温下,pH=6的酸性溶液中,不可能存在NH3·H2O分子
C.在0.1mol·L-1氢溴酸中加入适量的蒸馏水,溶液中c(OH-)减小
D.中性溶液中必然是c(H+)=c(OH-)=10-7mol·L-1
19.将80 mL NaOH溶液加到120 mL盐酸中,所得溶液pH=2,如果混前酸和碱的浓度相同,则它们的浓度是( )
A.0.5 mol/L B.0.1 mol/L C.0.05 mol/L D.1 mol/L
20.某温度下碳和水蒸气在密闭容器中发生下列反应:C + H2O(g)![]() CO(g) + H2(g)
CO(g) + H2(g)
CO(g) + H2O(g)![]() CO2(g) + H2(g) 当反应达平衡时测得c(H2) =1.9 mol/L,c(CO) = 0.1 mol/L。则CO2的浓度为
CO2(g) + H2(g) 当反应达平衡时测得c(H2) =1.9 mol/L,c(CO) = 0.1 mol/L。则CO2的浓度为
A.0.1 mol/L B.0.9 mol/L C.1.8 mol/L D.1.9 mol/L
二、填空题(本大题共3小题,共28分)
25.(10分)(1)将下列物质形成溶液:①硫酸 ②火碱 ③纯碱 ④小苏打 ⑤蓝矾 ⑥食盐 ⑦![]() ⑧次氯酸钠 ⑨
⑧次氯酸钠 ⑨![]() ⑩
⑩![]() .其中溶液
.其中溶液
pH>7的有________________________________________________
pH<7的有________________________________________________
pH=7的有________________________________________________
(2)将下列盐溶水形成溶液后回答:①判断能否水解 ②水溶液pH如何(等于7、大于7、小于7)③能水解的写出水解离子方程式,不能水解的说明理由.
(1)氯化铝________________________________________________________________
(2)硫化钠________________________________________________________________
26.(4分)把0.6molX气体和0.4molY气体混合于2L容器中,发生反应:
| |
| |
(2)上述反应在5min末时,已用去Y的物质的量占Y的原来物质的量分数是:
27.(14分)今有①CH3COOH、②HCl、③H2SO4 三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①=③>②
| |
| |
(2)当它们的物质的量浓度相同时,其pH的关系是A 。
| |
| |
| |
| |
| |
| |
(7)将pH相同的三种酸均稀释10倍后,pH关系为 F 。
三.实验题(本小题共1小题,共10分)
28.(10分) 某学生用0.1mol·L-1的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3厘米
E.调节液面至0或0以下刻度,记下读数
| |
| |
| |
(3)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(填偏高、偏低或无影响)
(4)判断到达滴定终点的实验现象是
| |
四、计算题(本题包括2小题,共12分)
29.在25℃时,向100 mL含HCl 14.6g的盐酸里放入5.6g纯铁粉(假设溶液体积不变),反应开始至2 min末收集到1.12LH2(标况),在此后又经4 min铁完全溶解.
求(1)在前2 min内,用FeCl2表示的速率是多少?
(2)在后4 min内,用HCl表示的速率是多少?
(3)前2 min与后4 min相比,反应速率哪个较快,为什么?
30. 将0.05mol/L的盐酸溶液和未知浓度的NaOH溶液以1︰2的体积比混和,所得溶液的pH=12,用上述NaOH溶液滴定pH=3的某一元弱酸溶液20mL,达到终点时消耗NaOH溶液12.5mL,试求:
(1)NaOH溶液的物质的量的浓度;
(2)此一元弱酸的物质的量的浓度。
|
| |
.
 一、选择题(只有一个正确答案,共20小题,每小题3分,共60分)
一、选择题(只有一个正确答案,共20小题,每小题3分,共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | D | D | C | C | D | D | A | B | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | B | C | A | B | D | A | A | C | B |
二、填空题(本大题共3小题,共28分)
25.(10分) 1.pH>7 ② ③ ④ ⑧ ⑩
pH<7 ① ⑤ ⑦ ⑨
pH=7 ⑥
2.(1)能水解 pH<7
![]()
![]()
![]()
(2)能水解 pH>7
![]()
![]()
![]()
![]()
![]()
![]()
26.(4分)
(1) 1 (2) 25%
27.(14分)
(1) A (2) A (3) H (4) B
(5) E (6) C ; F (7) F
三.实验题(本题包括1小题,共10分)
28.(1) BDCEAF
(2)因滴定管内壁有水珠,防止注入标准后溶液变稀,而使最终结果偏高
(3) 偏高 (4) 由无色变为粉红色,且半分钟内不褪色
(5) 偏低
四、计算题(本题包括2小题,共12分)
29.解:设5.6g Fe与x g HCl反应
![]()
![]()
x=7.3g ∴ HCl过量(14.6g)
![]()
![]() =
=![]() =
=![]()
y=2.8g Fe还有 5.6g-2.8g=2.8g
z=0.05 mol ![]()
(1)![]()
(2)![]()
![]()
a=0.1 mol(HCl)
![]()
![]()
(3)前2 min快!∵ 依(2)情况![]()
30.(1)0.04mol/L (2)0.025mol/L