高二化学会考模拟试卷(四)
第Ⅰ卷(机读卷 共60分)
可能用到的原子量: H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27
S—32 Cl—35.5 Fe—56
一、选择题(每小题只有一个选项符合题意。每小题2分,共36分)
1.通常情况下极易溶于水的气体是
(A)CH4 (B)O2 (C)HCl (D)Cl2
2.下列物质不属于“北京市空气质量日报”报道的是
(A)二氧化氮 (B)二氧化硫 (C)可吸入颗粒物 (D)二氧化碳
3.下列化合物中,只存在离子键的是
(A)NaOH (B)CO2 (C)NaCl (D)HCl
4.下列物质中,属于分子晶体的是
(A)食盐 (B)干冰 (C)金刚石 (D)二氧化硅
5.为了减少大气污染,北京市推广使用清洁汽车燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是
(A)碳氢化合物 (B)一氧化碳 (C)氢气 (D)醇类
6.既能跟盐酸反应又能跟氢氧化钠溶液反应的物质是
(A)NH4Cl (B)Al(OH)3 (C)Na2CO3 (D)AlCl3
7.1999年新发现的114号元素的一种同位素,其质量数为298,中子数为
(A)298 (B)184 (C)114 (D)70
8.下列各组物质中,互为同系物的是
(A)白磷和红磷 (B)乙烷和丁烷 (C)乙烯和丁烷 (D)16O和18O
9.苯跟溴的反应(C6H6+Br2→C6H5Br+HBr)属于
(A)取代反应 (B)加成反应 (C)消去反应 (D)酯化反应
10.下列实验操作中,正确的是
(A) 用托盘天平称量药品时,左盘放药品,右盘放砝码
(B) 向试管中滴加试剂时,将滴管下端紧靠试管内壁
(C) 烧瓶和烧杯在酒精灯上直接加热
(D) 使用试纸检验溶液的性质时,将试纸浸入溶液中
11.下列烷烃的命名中,正确的是
(A) 3―甲基丁烷 (B) 2―乙基丁烷 (C) 2,3―二甲基丁烷 (D) 3,4―二甲基丁烷
12.下列反应中,没有气体产生的是
(A)铜跟浓硝酸反应 (B)铜跟稀硝酸反应 (C)氧化铜跟稀硝酸反应 (D)碳酸铜跟稀硝酸反应
13.下列微粒的结构示意图中,表示氟离子的是
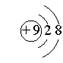 | 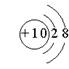 | 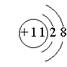 |  | ||||
(A) (B) (C) (D)
14.下列物质中,能用来检验酒精中是否含有水的是
(A)生石灰 (B)浓硫酸 (C)无水硫酸铜 (D)金属钠
15.下列关于2mol氧气的叙述中,正确的是
(A)质量是32 g (B)体积是44.8L (C)分子数是2×6.02×1023 (D)电子数是32
16.漂白粉的有效成分是
(A)CaCl2 (B)Ca(ClO)2 (C)CaSO4 (D)CaCO3
17.下列说法中,错误的是
(A)明矾可用于净水 (B)火柴盒侧面所涂的物质中含有白磷
(C)可用氮气保存粮食、水果 (D)碘化银可用于人工降雨
18.设NA为阿伏加德罗常数,下列说法中正确的是
(A)2.4g金属镁与足量盐酸完全反应,失电子总数为0.2NA (B)2NA个二氧化碳分子的质量为44g
(C)0.1mol/LNaCl溶液中,Na+与Cl-离子总数为0.2NA (D)17g氨气中所含原子数为NA
二、选择题(每小题有一个或两个选项符合题意。每小题3分,共24分。正确答案只有一个选项的,多选或错选给0分;正确答案有两个选项的,只要选错一个就给0分,只选了一个且为正确的给2分)
19.下列物质在氧化还原反应中,硫元素只表现氧化性的是
(A)H2S (B)SO2 (C)H2SO3 (D)H2SO4
20.下列各组中的元素,属于同一周期的是
(A)O、Na、S (B)Mg、Al、P (C)N、O、Cl (D)H、Li、Na
21.下列物质中,不能使酸性高锰酸钾溶液褪色的是
(A)乙烷 (B)乙烯 (C)乙炔 (D)苯
22.下列各组离子中,在溶液里不能大量共存的是
(A) K+ 、OH- 、 SO42- (B) Fe3+ 、Cl- 、 SCN - (C) Na+ 、CO32- 、NO3- (D) H+ 、Al3+ 、NO3-
23.下列说法中,正确的是
(A)用酒精清洗沾在皮肤上的苯酚 (B)用浓硫酸吸收氨气中的水分
(C)用稀硝酸洗去残留在试管壁上的银 (D)用酒精萃取碘水中的碘
24.能鉴别NaCl、NaBr和KI三种溶液的试剂是
(A)硝酸银溶液 (B)氯水 (C)稀硫酸 (D)溴水
25.下列离子方程式中,正确的是
(A) 氯化镁溶液跟氢氧化钠溶液反应 Mg2+ + 2OH- == Mg(OH)2↓
(B) 硫酸溶液跟氢氧化钡溶液反应 SO42- + Ba2+ == BaSO4↓
(C) 氯气通入氯化亚铁溶液中 Fe2+ + Cl2 == Fe3+ + 2Cl-
(D) 二氧化硫通入溴水使其褪色 SO2 + Br2 + 2H2O == 4H+ + 2Br- +SO42-
26.下列叙述中,正确的是
(A) 含金属元素的离子一定是阳离子
(B) 金属离子只能被还原,不能被氧化
(C) 金属氧化物不一定都是碱性氧化物
(D) 金属元素在化合物中既可显正价也可显负价
第Ⅱ卷(非机读卷 共40分)
可能用到的原子量: H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27
S—32 Cl—35.5 Fe—56
一、填空题(共16分)
1.(2分)碳酸氢钠俗称 ,在焰色反应中呈 色。
2.(2分)浓硫酸和浓硝酸常用 等金属制的容器贮存和运输,这是因为常温下,这些金属会在其中发生 现象。
3.(2分)分子式为C4H8的烯烃有3种同分异构体,其结构简式分别为 、 和CH3—C=CH2。
![]()
CH3
4.(3分)有一无色气体,可能含有HCl、NH3、NO、CO2、O2中的一种或几种。将其通入酸性AgNO3溶液中,有白色沉淀产生;与空气接触呈红棕色。则原气体中一定有 ;一定没有 ;不能确定的是 。
5.(3分)向a L 1mol/L的FeCl3溶液中加入b g铁粉,充分反应后,溶液中Fe3+和Fe2+的物质的量浓度相等。此反应的离子方程式为 ,a与b之比为 (最简整数比)。
6.(4分)A、B、C均为短周期元素,已知A与B位于同一主族,B+离子与C2-离子具有相同的电子层结构,B+离子比A原子多一个电子层。
(1) B与C可按2 : 1原子个数比形成一种化合物甲,也可按1 : 1原子个数比形成另一种化合物乙。在足量甲、乙中分别通入a mol二氧化碳气体,充分反应后固体质量各增加 g、________ g。
(2) A、B、C三种元素可形成一种离子化合物,这种化合物必须密闭保存,其原因是__________________________________________。
二、实验题(共14分)
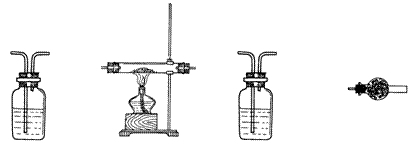
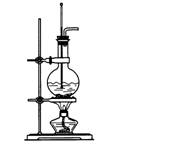 7.(3分)右图为实验室制备乙烯的装置图,请回答:
7.(3分)右图为实验室制备乙烯的装置图,请回答:
(1) 烧瓶中加入的两种试剂是 。
(2) 写出实验室制乙烯的化学方程式:
_____________________________________________。
(3) 实验室收集乙烯应采用_____________法。
8.(3分)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL。
(1)操作时,必须用到的仪器是 ______________________(填序号)。
①500mL容量瓶 ②250mL容量瓶 ③100mL烧杯 ④50mL量筒 ⑤10mL量筒
(2)操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是 。
(3)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是_______(填序号)。
①吸出多余液体,使凹液面与刻度线相切 ②小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
③经计算加入一定量的浓盐酸 ④重新配制
9.(4分)为测定由CO、NH3、CO2、H2组成的混合气体中各成分的体积分数,请用下列装置设计一个简单实验(装置不能重复使用,所用试剂均过量)。
 氧化铜
氧化铜
![]()
碱石灰
浓硫酸 Ba(OH)2溶液
① ② ③ ④
![]()
已知存在下列反应: 2NH3 +3 CuO 3Cu + N2 + 3H2O
请回答:
⑴ 混合气体通过各装置的顺序依次是( )→( ① )→( )→( );
⑵ 写出装置③中有关反应的离子方程式 ;
⑶ 装置③和④的位置不可互换,其原因是 。
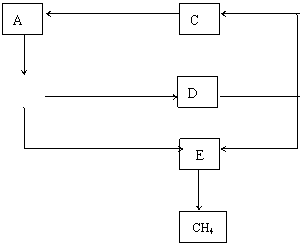
10.(4分)A、B、C、D、E是中学化学中常见的有机物,它们之间的反应关系如下图所示(图中部分反应条件和无机物已经略去):
 |
|
浓硫酸,加热
加热
(1)分子式与D相同的酯类物质共有 种;
(2)在生成A的反应过程中,C分子内被破坏的化学键是___________键(填序号);
① O—H ② C—H ③ C—C ④ C—O
(3)为了验证物质A的性质,某同学向2mL 2% 硫酸铜溶液中滴入4~5滴10% NaOH溶液,生成淡蓝色絮状沉淀,然后加入0.5mL A的稀溶液,加热,结果未出现红色的氧化亚铜沉淀。试分析实验失败的原因:___________________________________________ 。
三、计算题(共10分)
11.(4分)将11.2L氢气和14.2g氯气混合,使其在光照条件下充分反应,并将生成的氯化氢全部溶于水制成250mL溶液。试计算(气体体积均在标准状况下测定):
(1) 哪种反应物有剩余?剩余多少升?生成氯化氢的体积。
(2) 所得溶液的物质的量浓度。
12.(6分)请在以下(1)、(2)两小题中任选作一题。
(1)某同学在实验室进行甲、乙、丙、丁4组实验:各取40mL同浓度的盐酸,加入同一种镁铝合金粉末,合金质量和生成气体体积记录如下表。
| 实验序号 | 甲 | 乙 | 丙 | 丁 |
| 合金质量(g) | 0.204 | 0.306 | 0.408 | 0.510 |
| 生成气体体积(mL) (标准状况) | 224 | 336 | 448 | 448 |
请回答:
①盐酸的物质的量浓度为 ;
②乙组合金中镁的质量是 ;
③若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液,使产生的Al(OH)3沉淀恰好溶解,则需NaOH溶液的体积为 。
(2)由H2、C2H2、C2H4组成的1L混合气体在一定条件下发生加成反应后,气体总体积变成xL(气体体积均在标准状况下测定)。请回答:
①当反应后三种气体均无剩余时,x的取值范围是_____________;若x==0.4时,原混合气体H2、C2H2、C2H4的体积比为___________;
②当x==0.6,且反应后混合气体密度为0.714g/L时,原混合气体H2、C2H2、C2H4的体积比为 。
高二化学会考模拟试卷(四)
第Ⅰ卷(机读卷 共60分)
一、选择题(每小题2分,共36分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | D | C | B | A | B | B | B | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | C | C | A | C | C | B | B | A |
二、选择题(每小题3分,共24分)
| 题号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | ||||||||
| 答案 | D | B | AD | A | D | B | AC | A | C | AB | A | B | AD | A | D | C |
| 分数 | 3 | 3 | 3 | 2 | 2 | 3 | 3 | 2 | 2 | 3 | 2 | 2 | 3 | 2 | 2 | 3 |
第Ⅱ卷(非机读卷 共40分)
一、填空题(共16分)
1.(2分,每空1分) 小苏打 黄
2.(2分,每空1分) 铝、铁 钝化
3.(2分,每空1分) CH2==CHCH2CH3 CH3CH==CHCH3
4.(3分,每空1分) HCl、NO NH3、O2 CO2
5.(3分,第一空1分,第二空2分) 2Fe3+ + Fe == 3Fe2+ 5︰56
6.(4分,第一、二空各1分,第三空2分) (1)44a 28a
(2)该化合物会吸收空气中的水分而引起潮解;跟二氧化碳反应生成碳酸钠而使其变质
二、实验题(共14分)
7.(3分)(1)无水乙醇和浓硫酸1分(3)排水取气1分
![]() (2)CH3—CH2—OH
CH2==CH2↑+ H2O 1分
(2)CH3—CH2—OH
CH2==CH2↑+ H2O 1分
8.(3分)(1)②③④1分 (2)保证溶质全部转移到容量瓶中1分 (3)④1分
9.(4分)(1)( ④ )→( ① )→( ② )→( ③ ) 1分(2)CO2 + Ba2++ 2OH- == BaCO3↓+ H2O1分(3)从装置③带出的水蒸气进入装置①,使NH3测量不准2分
10.(4分)(1) 4 1分(2) ①② 1分(3)NaOH溶液的量不足,因反应必须在碱性条件下进行 2分
三、计算题(共10分)
11.(4分)![]() 解:(1)14.2g氯气的体积为:
解:(1)14.2g氯气的体积为:
设跟4.48LCl2反应的H2体积为x,反应后生成氯化氢的体积为y
H2 + Cl2 == 2HCl
1L 1L 2L
x 4.48L y
![]() x ==
x ==
![]()
氢气有剩余1分剩余氢气体积为:11.2L-4.48L==6.72L 1分 氯化氢的体积y== 1分
![]() (2)溶液的物质的量浓度为:
(2)溶液的物质的量浓度为:
1分
12.(6分) (1)① 1mol/L 2分② 0.144g 2分③ 88mL 2分(2)① 1/3﹤x﹤1/2 2分
3︰1︰1 2分② 7︰1︰22分
