高二化学第一次月考试卷(9月)
班级 学号 姓名 成绩
本卷可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 S:32 Cl:35.5 Fe:56 Cu:64
一、选择题(4×15=60分,每小题只有一个正确答案)
1、实验室可用下图所示的装置干燥、收集某气体R,并吸收多余的R,则R是( )
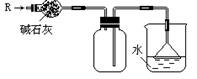
A.CH4 B.HCl C.Cl2 D.NH3
2、已知25%的氨水密度为0.91 g·cm-3,5%的氨水密度为0.98 g·cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是 ( )
A.等于15% B.大于15% C.小于15% D.无法判断
3、为加速漂白粉的漂白作用,最好的方法是 ( )
A.用水湿润 B.加热干燥 C.加NaOH溶液 D.加少量HCl
4、100mL 6mol/LH2SO4 与过量锌粉反应,在一定温度下,为减缓反应进行的速率,但又不影响生成H2的总质量,向反应物中分别加入适量的下列物质,其中不符合要求者 ( )
A.碳酸钠(固体) B.水 C.硫酸钠溶液 D.醋酸钠(固体)
5、将固体NH4Br
置于密闭容器中,在某温度下发生下列反应:NH4Br(s) ![]() NH3(g) + HBr(g) ,2HBr(g)
NH3(g) + HBr(g) ,2HBr(g) ![]() Br2(g)+H2(g),两分钟后,反应达到化学平衡,测知H2的浓度为0.5mol/L,HBr的浓度为4mol/L,若上述反应速率用V(NH3)表示,下列数据正确的是
( )
Br2(g)+H2(g),两分钟后,反应达到化学平衡,测知H2的浓度为0.5mol/L,HBr的浓度为4mol/L,若上述反应速率用V(NH3)表示,下列数据正确的是
( )
A.0.5mol/(L·min) B.2.5 mol/(L·min)
C. 2mol/(L·min) D.5 mol/(L·min)
6、在一定条件下,以物质的量之比1:3:2,在一密闭容器中充入A、B、C三种物质,可逆反应A(g) + 3B(g) ![]() 2C(g) 达到平衡的标志是: ( )
2C(g) 达到平衡的标志是: ( )
A. C生成的速率与C分解的速率相等 B. A、B、C的浓度相等
C. 单位时间生成nmolA,同时生成3nmolB
D. A、B、C的分子数之比为1:3:2
7、反应2A(g) ![]() xB(g)+2C(g),在一定条件下达到平衡时密闭容器的体积一定,压强增大了30%,A转化了20%,设温度不变,此反应中系数x的值为 (
)
xB(g)+2C(g),在一定条件下达到平衡时密闭容器的体积一定,压强增大了30%,A转化了20%,设温度不变,此反应中系数x的值为 (
)
A.2 B.3 C.4 D.5
8、在密闭容器中发生反应
2SO2 +O2 ![]() 2SO3(g),起始时SO2和O2分别为20moL和10moL,达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成份的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为:
( )
2SO3(g),起始时SO2和O2分别为20moL和10moL,达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成份的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为:
( )
A.10mol 10% B.20mol 20%
C.20mol 40% D.30mol 80%
9、在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应2R(g)+5Q(g) ![]() 4X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值为
( )
4X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值为
( )
A.2 B.3 C.4 D.5
10、把下列4种X溶液,分别加进4个盛有10mL2mol·L-1盐酸的烧杯中,并加水稀释到50mL,此时X和盐酸缓和地进行反应,其中反应速率最大的是 ( )
A.20mL,3mol·L-1 B.20mL,2mol·L-1
C.10mL,4mol·L-1 D.10mL,2mol·L-1
11、在2A+B![]() 3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A、v(A)=0.5 mol·L—1·s—1 B、v(B)=0.3 mol·L—1·s—1
C、v(C)=0.8 mol·L—1·s—1 D、v(D)=1 mol·L—1·s—1
12、在一个固定容积的密闭容器中,加入m mol A和n mol B,发生下列反应:mA(g)+nB(g)![]() pC(g),平衡时C的浓度为w mol·L—1。若维持容器体积和温度不变,起始时放入a mol A,b mol B,c mol C,要使平衡时C的浓度仍为w mol·L—1,则a、b、c必须满足的关系是
( )
pC(g),平衡时C的浓度为w mol·L—1。若维持容器体积和温度不变,起始时放入a mol A,b mol B,c mol C,要使平衡时C的浓度仍为w mol·L—1,则a、b、c必须满足的关系是
( )
A、a:b:c=m:n:p
B、a:b=m:n, ![]() +b=p
+b=p
C、![]() +a=m,
+a=m,![]() +b=n D、a=
+b=n D、a=![]() ,b=
,b=![]() ,c=
,c=![]()
13、0.3 molCu2S和HNO3反应,若生成物是Cu(NO3)2 、H2SO4、NO、H2O,则参加反应的硝酸中未被还原的硝酸的物质的量为 ( )
A.o.6 mol B.1.0 m C.1.2 mol D.2.2 mol
14、下列反应中,既能表现出硝酸的酸性,又能表现出硝酸的氧化性的是( )
A.FeO和HNO3 B.H2S和HNO3
C.Al(OH)3和HNO3 D.C和HNO3
15、据报道,科学家用激光将置于铁室中石墨靶上的碳炸松,同时用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜。这种化合物比金刚石更坚硬,其原因可能是 ( )
A.该化合物为离子化合物 B.碳氮键比金刚石中碳碳键更短
C.碳氮的单质化学性质均不活泼 D.氮原子的最外层电子数比碳多
二、填充题
16、氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl- 和SO42- 的反应速率与时间的关系如右图所示,已知这个反应速率随溶液中[H+]增大而加快。
(1)
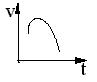 反应开始时反应速率加快的原因是_____
反应开始时反应速率加快的原因是_____
__ _;
用离子方程式表示: 。
(2) 反应后期反应速率下降的原因是_____________
_ 。
17、有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,在保持400℃条件下发生反应:2SO2 (g)+ O2(g)![]() 2SO3(g),并达到平衡。
2SO3(g),并达到平衡。
(1)达到平衡所需时间A容器比B容器_______,两容器中SO2的转化率A比B_______ 。
(2)达到(1)所述平衡后,若向容器中通入数量不多的等量Ar气,A容器的化学平衡向___________移动,B容器的化学平衡______移动。
(3)达到(1)所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数______,B容器中SO3的体积分数________。(填增大、不变、减小)
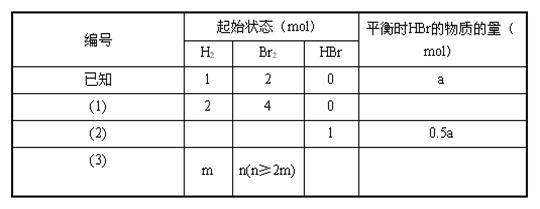
18、在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g) ![]() 2HBr(g),已知加入1mol H2与2mol Br2时,达到平衡后生成amol HBr(见下表已知项)。在相同条件下,要保持平衡时各组分的百分含量不变,对下列编号(1)~(3)的状态,填写表中的空白:
2HBr(g),已知加入1mol H2与2mol Br2时,达到平衡后生成amol HBr(见下表已知项)。在相同条件下,要保持平衡时各组分的百分含量不变,对下列编号(1)~(3)的状态,填写表中的空白:
19、反应A + B ![]() 2C,其中A为有色气体,其混合物颜色深浅与反应时间、温度(T)之间的关系如右图所示:(B、C均为无色物质)
2C,其中A为有色气体,其混合物颜色深浅与反应时间、温度(T)之间的关系如右图所示:(B、C均为无色物质)

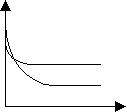
⑴该反应是 热反应(填“吸”、“放”)
⑵若A、B、C均为气态物质,增大压强时,B的转化率 ,混合气体颜色 。
⑶若A、B为气体物质,C为固态,增大压强时,A的转化率 。
三、计算题
20、在2L的密闭容器中充入2mol N2和3mol H2,在一定的条件下使其反应,5min末测得反应混合物中NH3占25%(体积分数)。求:
⑴5min内用H2浓度变化表示的平均反应速率。
⑵H2的转化率。
⑶5min末混合气的密度及平均相对分子质量 。
21、工业上制取HNO3的方法是将NH3催化氧化生成NO,NO再与O2反应生成NO2,然后NO2与水反应得HNO3和NO(NO循环使用),生成的硝酸再与NH3反应生成NH4NO3。
⑴写出NH3催化氧化的化学方程式 。
⑵将适量的氨气和二氧化氮置于一密闭容器中,用CuO—Cr2O3为催化剂,在一定温度下完全反应后,容器只有氮气和水蒸气,该反应可用于NO2污染的防治,其化学方程式为 。
⑶现有NH3100 t,将其一部分氧化制成HNO3,再与NH3反应生成NH4NO3,若每一步的转化率均为100%,则可生成NH4NO3 t。
⑷硝酸铵在受热条件下会发生分解,试配平该反应的化学方程式。
NH4NO3= N2↑+ HNO3+ H2O
答案: 111D、112C、1D、2A、3B、4AB、5B、6B、7A、8A、9A、12B、13C、14A、15B、16、A
16、开始阶段发生如下反应:
⑴2KClO3+6NaHSO3=3Na2SO4+2KCl+3H2SO4由于生成硫酸,氢离子浓度增大,则反应速率加快;
⑵随时间的延长,KClO3不断消耗,并有氢离子与亚硫酸氢根离子反应生成亚硫酸,则反应速率减慢
17、⑴短,大; ⑵逆反应方向,不; ⑶不变,增大
18、⑴2amol;⑵0,0.5mol;⑶2(n-2m)mol,(n-m)amol
19、⑴放 ⑵不变 变深 ⑶增大 23.1%
20、.⑴0.15mol·(L·min)-1,⑵50%,⑶31g·L-1,15.5。
21、⑴4NH3+5O2![]() 4NO+6H2O ⑵8NH3+6NO2
4NO+6H2O ⑵8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
⑶235.3 ⑷5、4、2、9