高二化学第一学期期中考试试卷10
相对原子质量:H-1;O-16;Ca-40;P-31。
所有题目的答案均写在答题卡上
一、单选题:(16×3’)
1.关于氮气的性质的说法中,错误的是( )
A.通常情况下,氮气的性质很不活泼。
B.可在氧气中燃烧,生成NO。
C.在水中溶解度小(通常情况下)。
D.跟H2在一定条件下发生反应,N2是氧化剂。
2. 已知反应A+3B====2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·s-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol·L-1·s-1 B.1 mol·L-1·s-1
C.2 mol·L-1·s-1 D.3 mol·L-1·s-1
3.下列事实中不能用平衡移动原理解释的是( )
A. 密闭、低温是存放氨水的必要条件。
B. 硝酸工业生产中,使用过量空气以提高NH3的利用率。
C. 实验室常用排饱和食盐水法收集氯气。
D.在FeSO4溶液中,加入铁粉以防止氧化。
4.在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器残留![]() 体积的气体,该气体与空气接触后变成红棕色,则m与n的比值为( )
体积的气体,该气体与空气接触后变成红棕色,则m与n的比值为( )
A.3:2 B.2:3 C.8:3 D.3:8
5.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质的质量比( )
A.1:2 B.1:3 C.3:1 D.1:1
6.下列反应中,硝酸既表现了氧化性又表现了酸性的是( )
A.FeO+HNO3 B. Fe2O3+HNO3 C.Al(OH)3+HNO3 D.S+HNO3
7.20世纪20年代,化学家创立了酸碱质子理论,其要点是凡能给出质子的分子或离子都是酸;凡能接受质子的分子或离子都是碱。按此观点,下列粒子既属于酸又属于碱的是( )
①H2O;②CO32-;③Al3+;④CH3COO-;⑤NH4+;⑥HCO3-;
A.②③ B.①⑥ C.④⑥ D.⑤⑥
8.把0.05molNaOH固体分别加入到下列100ml液体中,导电能力基本不变的是( )
A.自来水 B.0.5mol·L-1醋酸溶液 C.0.8 mol·L-1盐酸
D.0.5 mol·L-1的NaCl溶液
9.在反应aBrF3+bH2O=====cHBrO3+dHBr+eHF+fO2中(a、b、c、d、e、f是各物质的化学计量数),若0.3molH2O被氧化,则被水还原的BrF3的物质的量是( )
A.0.15mol B.0.2mol C.0.3mol D.0.4mol
10.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)=====2C(g)反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则反应B的转化率为( )
A.80% B.40% C.20% D.50%
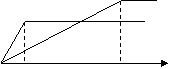
11.反应2X(g)+Y(g)====2Z(g) (正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n)与反应时(t)的关系如图所示,下列判断正确的是( )
A. T1<T2;P1<P2
B. T1<T2;P1>P2
C. T1>T2;P1>P2
D.T1>T2;P1<P2
 |
![]() n
n
![]()
![]() T2 P1
T2 P1
T2 P2
T1 P2
0 t
12.某由水电离出的C(H+)=10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
A.Na+、Cl-、H+、SO42- B.K+、OH-、CO32-、Cl-
C.Na+、Cl-、NO3-、K+ D.Mg2+、NH4+、Cl-、SO42-
13.标准状况下,16.8LNH3恰好被含有49g磷酸溶液吸收,则生成的盐是( )
A.NH4H2PO4 B.(NH4)2HPO4 C.NH4H2PO4和(NH4)2HPO4
D. (NH4)3PO4和(NH4)2HPO4
14.可逆反应A(g)+B(g)=====2C(g)在固定容积的容器中进行。如果向容器中充入1molA和1molB,在某温度下达到平衡时,C的体积分数为m%,若向容器中充入1molC,在同样温度下达到平衡时,C的体积分数为n%,则m和n的正确关系是( )
A.m>n B.m<n C.m=n D.无法比较
15.下列各溶液中,pH最大的是( )
A.pH=4的醋酸和pH =10的烧碱溶液等体积混合。 B.pH=5的盐酸稀释1000倍。
C.pH=9的烧碱溶液稀释1000倍。 D.pH=9的氨水稀释1000倍。
16.等体积等物质的量的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子的浓度满足的关系是( )
A.C(M+)=C(A-);C(OH-)=C(H+) B. C(M+) >C(OH-)>C(A-)>C(H+)
C. C(M+)>C(A-) >C(H+) >C(OH-) D. C(M+)+ C(H+)=C(A-)+C(OH-)
二、填空题(共3题,共28分)
17.(6分)已知RXO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2mol RXO42-离子参加反应时共转移0.4mole-。请填空:
(1)反应的氧化产物为_________________;
(2)x=_______________________;
(3)参加反应的H+的物质的量为______________________。
18.(12分)在一定条件下,xA+yB===zC的反应达平衡。
(1) 已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是______________。
(2) 已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向________移动。
(3) 已知B、C是气体,当其它条件不变,增大A的物质的量时,平衡不移动,则A是__________态。
(4) 加热后C的质量分数减少,则正反应是________(填“放热”或“吸热”反应)。
19.(10分)(1)除H+、OH-外,某中性溶液中已肯定存在Na+、NH4+、Cl-,第四种肯定存在的离子在下列离子中选择:K+、CH3COO-、NO3-、ClO4-。
你认为是哪一种?_________理由是_______________________________________________。
(2)通过简单的实验证明Cu(OH)2是一种弱碱___________________________________。
(3)用简单实验证明Na2CO3能水解,且温度越高水解程度越大_______________________。
三、推断题(共10分)
20.固体W是一种不含结晶水的晶体,它有如下图所示的变化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() A
W 白色沉淀
A
W 白色沉淀
![]()
![]() E
E
![]()
![]()
![]()
![]()
![]()
![]() D
H2O
D
H2O
![]()
![]()
![]()
![]() W
B
W
B
![]()
![]()
![]()
![]() E
E
![]()
![]() B
B
![]()
![]()
![]() C
C
(1)D的分子式________________
(2)W溶液与盐酸反应的离子方程式______________________________
(3) W受热分解的化学方程式______________________________-
(4) 将盛有B与C的混合气体20mL的试管倒置于水中,液面不断上升,最终试管内剩余气体5mL,则混合气体中B气体的体积为__________mL或________mL
四、计算题(共2题,共14分)
21.(6分)某温度下在1L密闭容器中加入1molN2和3molH2,使反应N2+3H2=====2NH3达平衡,测得平衡混合气中N2、H2、NH3浓度分别为M、N、Gmol·L-1,如果保持温度不变,只改变最初物质的加入量,而要求M、N、G总保持不变,则N2、H2、NH3的加入量用x、y、z表示时,应满足的条件是:
(1) 若x=0,y=0,则z=_________
(2) 若x=0.75mol,则y=_________,z=______________。
22.有一组成为Ca3(PO4)2·nH3PO4·mH2O的磷酸酸式盐。取该晶体7.56g加热至150℃使之脱去全部结晶水,残余物的质量为7.02g;再取该晶体7.56g溶于水配成溶液需加4.44gCa(OH)2才能使其全部转化为正盐,试解答:
(1) 求Ca3(PO4)2·nH3PO4·mH2O中的m、n的值。
(2) 用酸式盐的形式写出其最简式。
