高二化学第一学期期中考试试卷
本试卷中可能用到的原子相对质量 H ~ l C ~ 12 N ~ 14 O ~ 16 Cu ~ 64
一、选择题(每小题3分,共30分。每小题只有一个选项符合题意)
1.下列金属中,在冷的浓硝酸中最难溶解的是 ( )
A Cu B Ag C Al D Mg
2.实验室制取下列气体时,与实验室制氨气的气体发生装置相同的是 ( )
A Cl2 B O2 C H2 D CO2
3.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四种无色溶液区分开的一种试剂是(必要时可加热)( )
A Ba(OH)2 B Ba(NO3)2 C NaOH D AgNO3
4.在2 L容器中,加入4mol A和6mol B 发生下列反应:4A(g)+6B(g) ===== 4C(g)+5D(g),经过10 s,剩下2mol A,则用B表示的反应速率是 ( )
A 0.1mol/(L·s ) B 0.225mol/(L·s )
C 0.15mol/(L·s ) D 0.9mol/(L·s )
5.有三支试管,分别加入下列物质,
甲:10mL 0.01mol·L-1 FeCl3溶液 和10mL 0.01mol·L-1 KSCN溶液
乙:5mL水10mL 0.01mol·L-1 FeCl3溶液 5mL 0.01mol·L-1 KSCN溶液
丙:10mL 0.1mol·L-1 FeCl3溶液 和10mL 0.1mol·L-1 KSCN溶液
观察这三支试管的颜色,其中颜色最浅的是( )
A甲试管 B乙试管 C丙试管 D无法判断
6.合成氨采用500℃左右的温度进行,主要是因为在该温度时( )
A 合成氨的化学反应速率最大
B N2的转化率最高
C 催化剂的活性最大
D NH3在平衡混合气体中的体积分数最大
7.在NO2与水反应中,发生还原反应和氧化反应的物质的质量之比为( )
A 3:1 B 1:3 C 1 :2 D 2 :1
8.既能用浓H2SO4又能用碱石灰干燥的气体是( )
A Cl2 B SO2 C NH3 D NO
9.当可逆反应:2SO2 + O2
![]() 2SO3
达到平衡后,通入18O2,一定时间后,18O存在于(
)
2SO3
达到平衡后,通入18O2,一定时间后,18O存在于(
)
A O2 B SO3、SO2 C SO2、SO3、O2 D SO3、O2
10.在合成氨反应中N2+3H2 ![]() 2NH3中,能使化学反应速率减小的是 (
)
2NH3中,能使化学反应速率减小的是 (
)
A 增大压强 B 升高温度
C 保持体积不变,加入氩气 D 保持压强不变,加入氩气
二、选择题(每小题4分,共52分。每小题有一个或两个选项符合题意)
11.下列含氮的化合物是酸酐的是( )
A NO B NO2 C N2O3 D N2O5
12.下列措施能增大单位体积内活化分子的百分数的是( )
A 增大浓度 B 增大压强 C 升高温度 D 加催化剂
13.下列各组比较中,正确的是 ( )
A 原子半径:N<P<S B 稳定性:NH3< H2O < HF
C 碱性:Sb(OH)3>Bi(OH)3 D 酸性:H3AsO4> H2SeO4> HBrO4
14.下列离子方程式中正确的是 ( )
A 磷酸溶液中滴入过量氢氧化钠溶液:H3PO4+OH-=H2PO42-+H2O
B 铜与稀硝酸的反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
C 硫酸铵溶液与氢氧化钡溶液的反应:NH4++OH-=NH3↑+H2O
D 锌与稀硝酸的反应:Zn+2H+=Zn2++H2↑
15.在一定温度的密闭容器中,下列能证明可逆反应![]()
![]()
![]() 达到平衡的是( )
达到平衡的是( )
A 氨气的生成速率与氨气的分解速率相等
B 单位时间内,生成a mol氮气的同时生成3a mol的氢气
C 氮气、氢气、氨气的分子个数比为1:3:2
D 单位时间内,断裂6molN-H键的同时断裂3mo1H-H键
16.密闭容器中,反应x A(g)+y B(g)![]() z C(g)达平衡时,A的浓度为0.5mol/L,若保持温
z C(g)达平衡时,A的浓度为0.5mol/L,若保持温
度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正
确的是( )
A x + y<z B 平衡向正反应方向移动
C B的转化率降低 D 正反应为吸热反应
17.在水溶液中存在下列平衡:Cr2O72-+ H2O ![]() 2CrO42-+ 2H+
2CrO42-+ 2H+
(橙红色) (黄色)
现欲使橙红色的K2Cr2O7溶液向黄色转化,可采取的措施是( )
A 加入少量HCl B 加入少量NaOH C 加入少量水 D 蒸发浓缩
18.已知25%氨水的密度为![]() ,5%氨水的密度为
,5%氨水的密度为![]() ,若将上述两溶液等体积混合,所得氨水溶液的质量分数是(
)
,若将上述两溶液等体积混合,所得氨水溶液的质量分数是(
)
A 等于15% B 大于15%
C 小于15% D 无法估算
19.a克Cu与含b克HNO3的硝酸溶液恰好反应,若a:b=8:21,则反应中被还原硝酸的质量为 ( )
A b克 B b/2克 C 3b/4克 D b/4克
20.下列可逆反应达到平衡后,升高温度可使混合气体平均相对分子质量增大的是( )
A 2NO2 (g) ![]() N2O4 (g) (正反应为放热反应)
N2O4 (g) (正反应为放热反应)
B 2SO3 (g) ![]() 2SO2 (g) + O2 (g) (正反应为吸热反应)
2SO2 (g) + O2 (g) (正反应为吸热反应)
C H2 (g) + I2 (g) ![]() 2HI (g) (正反应为放热反应)
2HI (g) (正反应为放热反应)
D 4NH3 (g) +
5O2 (g)
![]() 4NO (g) +
6H2O(g) (正反应为放热反应)
4NO (g) +
6H2O(g) (正反应为放热反应)
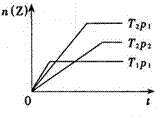 21.反应2X(g)+Y(g)
21.反应2X(g)+Y(g) ![]() 2Z(g)(正反应为放热反应),在不同温度(T1和
2Z(g)(正反应为放热反应),在不同温度(T1和
T2)及压强(p1和p2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下述判断正确的是( )
A T1<T2,p1<p2
B T1<T2,p1>p2
C T1>T2,p1>p2
D T1>T2,p1<p2
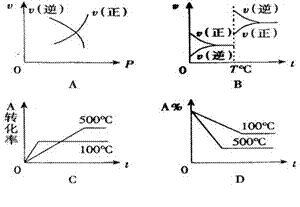 22.对于可逆反应:A(g)+2B(g)
22.对于可逆反应:A(g)+2B(g)![]() 2C(g)(正反应为吸热反应),下列图象正确的是( )
2C(g)(正反应为吸热反应),下列图象正确的是( )
23.0.3 molCu2S与足量的浓硝酸反应,生成硝酸铜、硫酸、二氧化氮和水,则参加反应的硝酸中,被还原的硝酸的物质的量是( )
A 0.4 mol B 0.2 mol C 0.05 mol D 3.0 mol
三、填空题(34分)
24.(1)配平下列方程式:(4分)
① P4 + HNO3 + H2O—— H3PO4 + NO
② MnO4- + Fe2+ + H+—— Mn2+ + Fe3+ + H2O
(2) 氧化剂MO(OH)2 + 中M元素的化合价为+5,25mL 0.028mol/L的Na2SO3溶液恰好将含有2.8×10 -4 mol MO(OH)2 + 的溶液还原并生成SO42-,则M元素在产物中的化合价为 。(2分)
25.在某温度下,A+B![]() 2C类型的反应达到平衡:
2C类型的反应达到平衡:
(1)若升高温度时C的浓度减小,则正反应是_____热反应,在升高温度时,正反应速率
______(填“增大”、“减小”或“不变”,下同),逆反应速率_______。
(2)在增加或减少B物质时,平衡不移动,则B物质为________态。
(3)若A为气态物质,增大压强平衡不移动,则B物质为______态,C为______态。
(4)若加入正催化剂,平衡______移动,达到平衡状态的时间______ (填“延长”、“缩短
或“不变”)。(8分)
26.某混合气体中可能含有N2、O2、HCl、NH3、NO、NO2中的两种或多种气体,现将此无色透明的混合气体通过浓硫酸后,气体体积明显减小,当剩余气体与空气接触时,立即变为红棕色,则原混合气体中一定含有的气体是______,一定不含的气体是______,可能存在的气体是______。(6分)
![]() 27.某温度下1L密闭容器中1molN2和3molH2,使反应N2 +3 H2 2NH3达到平衡,测得平衡混合气体中N2、H2、NH3物质的量分别为 m mol、 n mol、g mol。如果温度不变,只改变初始加入的物质的量,而要求m、n、q的值不变,则N2、H2、NH3加入的物质的量用x、y、z表示时,应满足条件:
27.某温度下1L密闭容器中1molN2和3molH2,使反应N2 +3 H2 2NH3达到平衡,测得平衡混合气体中N2、H2、NH3物质的量分别为 m mol、 n mol、g mol。如果温度不变,只改变初始加入的物质的量,而要求m、n、q的值不变,则N2、H2、NH3加入的物质的量用x、y、z表示时,应满足条件:
(1)若x=0,y=0,则z= mol。(2)若x=0.25mol,则 y= mol,z= mol。
(3)x、y、z应满足的一般条件是(用两个方程式来表示) 。(8分)
![]() 28.在某固定容积的密闭容器中,存在下列化学平衡:aA(g) bB(g)+cC(g),在温度不变的条件下,向容器中再充入一定量的A物质,重新达到平衡时,判断在下列情况下有关物质量的变化趋势(在下列空白中填写“增大”“减小”或“不变”)
28.在某固定容积的密闭容器中,存在下列化学平衡:aA(g) bB(g)+cC(g),在温度不变的条件下,向容器中再充入一定量的A物质,重新达到平衡时,判断在下列情况下有关物质量的变化趋势(在下列空白中填写“增大”“减小”或“不变”)
(1)当a=b+c时,B的物质的量分数___________。
(2)当a>b+c时,A的物质的量分数___________。
(3)当a<b+c时,A的转化率___________。(6分)
四、实验题(18分)
29.在室温下,2NH3+3Cl2=N2+6HCl,根据以上原理,可以制取纯净干燥的氮气,现有如下图所示仪器,并有①饱和食盐水 ②浓硫酸 ③碱石灰 ④浓盐酸 ⑤固体氢氧化钙
⑥二氧化锰 ⑦固体氯化铵。设计的制取过程是:
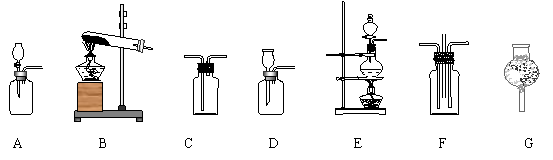
![]()
请回答下列问题:
(1)制取纯净干燥的氨气应使用的仪器为_________(填仪器编号),使用的试剂为__________。(填试剂序号)
(2)制取Cl2的化学反应方程式为____________________________________。
(3)在制取的N2中含有少量的氨气和氯气,为了除去氨气和氯气,并得到干净的N2,可将混合气体先通过_____________,再通过____________。(以上两空填试剂序号)
(4)当反应装置里的氨气和氯气的物质的量比小于__________时,尾气里一定含有较多的氯气;当反应装置里的氨气和氯气的物质的量比大于_______时,尾气里一定含有较多的氨气。(10分)
30.某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0,现反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,现反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
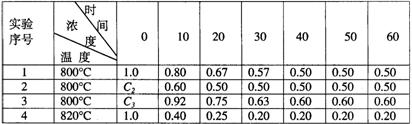
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
理由是 。
(3)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。(8分)
五、计算题(16分)
31.在一定温度和压强下,N2和H2以1:3的体积比相混合,反应达到平衡时氨气的体积分数为25%,求:(1)此时混合物中N2的体积分数 (2)计算H2的转化率。(6分)
32.在一支10mL的试管里充满NO2和O2的混合气体,将其倒立于充满水的水槽中充分反应:
① 若原气体中含2mLNO2,则最后试管内剩余气体(O2)________ mL。
② 若原气体中含9mLNO2,则最后试管内剩余气体(NO)________ mL。
 ③ 若原气体中NO2的体积为x mL,最后试管内剩余气体为y
mL,试求当x取值不同时,y与x的关系式y=f(x)。并在下图坐标系中画出y=f(x)的关系曲线。(10分)
③ 若原气体中NO2的体积为x mL,最后试管内剩余气体为y
mL,试求当x取值不同时,y与x的关系式y=f(x)。并在下图坐标系中画出y=f(x)的关系曲线。(10分)
高二化学第一学期期中考试答卷
一、选择题(每小题3分,共30分。每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二、选择题(每小题4分,共52分。每小题有一个或两个选项符合题意)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
三、填空题(34分)
24.(1)① 、 、 、 、 (2分)
② 、 、 、 、 、 (2分)
(2) (2分)
25.(1) 热反应,______, (以上两空填“增大”、“减小”或“不变”)
(2) 态
(3)______态, ______态
(4)______, ______ (填“延长”、“缩短”或“不变”)(8分)
26. , , (6分)
27.(1) mol (2)y= mol,z= mol
(3) (8分)
28. ( 填写“增大”“减小”或“不变”)
(1) ___________
(2) ___________
(3) ___________(6分)
四、实验题(18分)
29.(1)________(填仪器编号), (填试剂序号)
(2)____________________________________
(3)_____________, _______ _____(以上两空填试剂序号)
(4)__________、____ ___(10分)
30.(1) mol/(L·min)
(2) 反应(选填吸热、放热),理由是
(3)C2= mol/L, (8分)
五、计算题(16分)
31.(6分)解:
32.(10分)① 剩余气体(O2)________ mL
② 剩余气体(NO)________ mL(直接填写答案)
③ (要写过程)
 |
高二化学第一学期期中考试答案
一、选择题(每小题3分,共30分。每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | A | C | B | C | C | D | C | D |
二、选择题(每小题4分,共52分。每小题有一个或两个选项符合题意)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
| CD | CD | B | B | AD | C | BC | C | D | D | C | D | D |
三、填空题(34分)
24.(1)① 3 、 20 、 8 、 12 、 20 (2分)
② 1 、 5 、 8 、 1 、 5 、 4 (2分)
(2) 0 (2分)
25.(1) 放 热反应, 增大 , 增大 (以上两空填“增大”、“减小”或“不变”)
(2) 固或液 态
(3) 气 态, 气 态
(4) 不 , 缩短 (填“延长”、“缩短”或“不变”)(8分)
26. NH3、NO , NO2、HCl、O2 , N2 (6分)
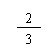 27.(1) 2 mol (2)y= 0.75 mol,z= 1.5 mol
27.(1) 2 mol (2)y= 0.75 mol,z= 1.5 mol
(3) y=3x , 2x+z=2或 y+z=2 (8分)
28. ( 填写“增大”“减小”或“不变”)
(3) 不变
(4) 减小
(3) 减小 (6分)
四、实验题(18分)
|
(2)MnO2 + 4HCl(浓)===== MnCl2 + Cl2 + 2H2O
(3) ② , ③ (以上两空填试剂序号)
(4)2:3 、 8:3 (10分)
30.(1) 0.013 mol/(L·min)
(2) 吸 反应(选填吸热、放热),理由是温度升高,平衡向正反应方向移动
(3)C2= 1.0 mol/L, 加入催化剂 (8分)
五、计算题(16分)
31.(6分)解: N2 + 3 H2 ===== 2 NH3
起始 1 3 0
转化 α 3α 2α (2分)
平衡 1-α 3-3α 2α
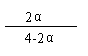 |
V %= = 0.25(1分),α= 40% (1分)
V(N2)% = (1-0.4)/(4-0.8) = 18.8% (2分)
(或用差量法)
32.(10分)① 剩余气体(O2) 7.5 mL (2分)
② 剩余气体(NO) 1.67 mL(直接填写答案)(2分)
③ (要写过程)
方程式和过程略 (2分)
![]() 10 – 5/4 x (0< x <8)
10 – 5/4 x (0< x <8)
y = f(x)= 0 (x=8) (2分)

1/3(5x - 40) (8<x<10)
图象(2分)